Типы противодиабетических таблеток. Блокаторы ДПП‑4 Дпп 4 эндокринология
За последние десятилетия достигнуты существенные успехи в изучении патогенеза сахарного диабета (СД), раскрыты многие тонкие патофизиологические механизмы, лежащие в основе развития этого заболевания. Сегодня общепризнано, что СД 2-го типа обусловлен, с одной стороны, снижением чувствительности к инсулину периферических тканей (инсулинорезистентностью), а с другой - уменьшением секреции инсулина. Соответственно большинство существующих пероральных антидиабетических средств оказывают воздействие на одно из этих патогенетических звеньев: либо, как инсулиносенситайзеры, повышают чувствительность тканей к эндогенному инсулину, либо, как производные сульфонилмочевины, стимулируют секрецию инсулина b-клетками поджелудочной железы. Некоторые препараты обладают другим механизмом действия - уменьшают абсорбцию глюкозы в тонком кишечнике.
Ввиду того что в современном обществе число людей, страдающих СД 2-го типа, к сожалению, неуклонно возрастает, проблема повышения эффективности лечения этого заболевания и его осложнений становится все более актуальной. Огромный интерес представляет разработка противодиабетических препаратов, основанных на абсолютно новых принципах действия. Важнейшим требованием к таким препаратам, наряду с высокой терапевтической эффективностью, является более совершенный профиль безопасности, а также способность оказывать благоприятное влияние на сопутствующие факторы, способствующие дальнейшему прогрессированию сахарного диабета и развитию его осложнений.
Именно к таким средствам относится новый класс пероральных антидиабетических препаратов - так называемые ингибиторы дипептидилпептидазы 4-го типа (ДПП-4), создание которых вплотную приблизило ученых и клиницистов к возможности восстановления нарушенной функции островковых клеток поджелудочной железы. Механизм действия этих препаратов связан с ингибированием фермента ДПП-4, который расщепляет инкретины - естественные факторы, способствующие секреции инсулина в ответ на прием пищи и регулирующие уровень гликемии как натощак, так и постпрандиально. В условиях имеющего место при СД 2-го типа снижения образования инсулина в сочетании с резистентностью периферических тканей к его действию пролонгирование активности инкретинов с помощью ингибиторов ДПП-4 обеспечивает выработку инсулина исключительно в ответ на прием пищи c одновременным подавлением выделения «контринсулинового» гормона - глюкагона. Это воздействие ингибиторов ДПП-4 может помочь скорректировать характерное для СД 2-го типа нарушение секреции инсулина в ответ на прием пищи, т.е. сделать более физиологичным профиль инсулиновой секреции у больных. Ингибиторы ДПП-4, применяемые в виде монотерапии или в комбинации с другими сахароснижающими средствами, способствуют улучшению характеристик углеводного обмена, но это происходит без увеличения массы тела пациентов (как при комбинации с препаратами сульфонилмочевины или глитазонами) и без повышения риска развития гипогликемии (как при комбинации с препаратами сульфонилмочевины).
1. Что такое инкретины и «инкретиновый эффект»?
Инкретины являются пептидами, которые стимулируют глюкозозависимую секрецию инсулина и в последнее время вызывают значительный интерес вследствие их противодиабетического действия. Кроме стимулирования секреции инсулина, они усиливают все стадии биосинтеза инсулина и связаны с улучшением функции b-клеток. Доклинические исследования показали, что они защищают b-клетку, повышая дифференциацию и пролиферацию и уменьшая апоптоз; в моделях на животных установлена связь с повышением массы b-клеток .
Наиболее активными из инкретинов являются глюкагоноподобный пептид-1 (ГПП-1) и глюкозозависимый инсулинотропный полипептид (ГИП). ГПП-1 является инкреторным гормоном, который, помимо стимуляции секреции инсулина, уменьшает секрецию глюкагона, угнетая таким образом эндогенное образование глюкозы, уменьшая колебания постпрандиального уровня глюкозы в крови. Кроме того, под влиянием ГПП-1 снижается аппетит, что приводит к меньшему потреблению пищи и снижению массы тела; ускоряется продвижение химуса по желудочно-кишечному тракту, может также наблюдаться положительное воздействие на сердечно-сосудистую систему . В то время как влияние на b-клетку является общим для обоих инкретинов, ГИП не угнетает секрецию глюкагона и не влияет на опорожнение желудка и потребление пищи . Однако ГИП может играть роль в регуляции липидного обмена .
Изучение инкретинов началось еще в прошлом веке. В 1902 г. Baylis и Starling описали фактор, который вырабатывается в тонком кишечнике и стимулирует секрецию поджелудочной железы; термин «инкретин» впервые появился в 1932 г. ГИП - первый инкретин человека - был выделен в 1973 г.; в 1987 г. открыт человеческий ГПП-1.
В 1964 г. был впервые описан «инкретиновый эффект» в эксперименте, когда ответ со стороны секреции инсулина был более выраженным при пероральном применении глюкозы, чем при внутривенном ее введении . «Инкретиновый эффект» приводит к усиленной глюкозозависимой секреции инсулина b-клетками поджелудочной железы. Согласно оценкам M. Nauck et al., приблизительно 60 % инсулина, секретируемого в ответ на прием пищи, является следствием данного эффекта . В 1986 г. обнаружено снижение эффекта инкретина при СД 2-го типа .
ГПП-1 существует в виде двух биологически активных пептидных форм, производных предшественника пептида проглюкагона (препроглюкагон). Изоформа, включающая 30 аминокислотных остатков, ГПП-1(7-36)-амид, составляет около 80 % ГПП-1, обнаруживаемого в кровеносном русле , являясь основной активной пептидной формой этого инкретина.
В 1995 г. показано, что в физиологических условиях циркулирующие ГПП-1 и ГИП расщепляются ферментом ДПП-4. Этот фермент отщепляет по два аминокислотных остатка от N-терминального конца интактных биологически активных форм инкретинов, что приводит к образованию укороченных фрагментов гормонов, почти полностью лишенных гормональной активности. Эти данные легли в основу идеи о том, что создание ингибиторов фермента ДПП-4 может стать эффективным средством физиологического контроля гликемии путем поддержания эффектов глюкагоноподобных пептидов.
Семейство ДПП-4 - это подсемейство полиоловых олигопептидаз, включающее 4 фермента: ДПП-4, белок активации фибробластов, ДПП-8, ДПП-9 и два белка без ферментативной активности: ДПП-4-подобный белок-6 и ДПП-10. ДПП-4 - наиболее широко распространенный фермент этой группы, представленный как в виде пептидазы, связанной на поверхностной мембране клетки, так и в растворимой форме, циркулирующей в плазме крови. У людей ДПП-4 экспрессируется в клетках эпителия, капиллярах эндотелия и в лимфоцитах. Это включает экспрессию в желудочно-кишечном тракте, желчных протоках, экзокринных панкреатических клетках, почках, тимусе, лимфатических протоках, мочевом пузыре, паротидных и молочных железах, печени, селезенке, легких, мозге. ДПП-4 состоит из 766 аминокислотных остатков и из двух доменов: N-концевого b-пропеллерного домена и С-концевого a-/b-гидролазного домена. ДПП-4 является каталитически активной в виде димера, а доступ к активному центру осуществляется путем открытия просвета между b-пропеллером и гидролазным доменом. Субстратами ДПП-4 являются различные нейропептиды, гормоны и хемокины. ГПП-1 и ГИП - эндогенные физиологические субстраты ДПП-4, концентрация которых в циркуляции invivo прямо связана с активностью ДПП-4 .
Физиологические эффекты инкретинов осуществляются путем связывания со специфическими рецепторами, которые располагаются во многих органах, включая поджелудочную железу и мозг . В кровяном русле период полужизни ГПП-1 составляет от 60 до 90 секунд вследствие быстрого разрушения его ферментом ДПП-4 с образованием метаболитов, которые могут действовать как антагонисты рецепторов ГПП-1 .
Инкретины высвобождаются в кровеносное русло из клеток кишечника в течение всего дня, их уровни возрастают в ответ на прием пищи. ГИП секретируется К-клетками кишечника, а ГПП-1 - L-клетками, причем после приема пищи ГИП циркулирует в крови в концентрациях, в 10 раз превышающих концентрации ГПП-1. Оба инкретина имеют сходные инсулинотропные эффекты при концентрациях глюкозы до 108 мг/дл (6,0 ммоль/л), но при уровне глюкозы выше 140 мг/дл (7,8 ммоль/л) ГИП оказывает незначительное влияние на секрецию инсулина . В отличие от ГПП-1 ГИП не подавляет секрецию глюкагона. Поскольку степень влияния ГПП-1 на секрецию инсулина зависит от концентрации глюкозы в плазме крови, то по мере приближения уровня гликемии к нормальным значениям стимуляция ГПП-1 секреции инсулина уменьшается.
Инсулинотропное действие ГПП-1
Функциональная связь в рамках гормональной регуляции «кишечник - поджелудочная железа» носит название энтероинсулярной оси. Проведены обширные экспериментальные исследования энтероинсулярной оси в норме и при таких патофизиологических состояниях, как ожирение и СД 2-го типа, в которых показано, что инкретины вызывают увеличение секреции инсулина как при нормальном уровне глюкозы, так и, в особенности, при гипергликемии.
Инсулинотропные эффекты ГПП-1 были подробно изучены в опытах на животных. Так, у мышей с нарушенной толерантностью к глюкозе ГПП-1 повышает способность b-клеток отвечать на гипергликемию . Аналогичным образом при обработке ГПП-1 изолированных b-клеток поджелудочной железы крыс клетки становятся чувствительными к уровню глюкозы и отвечают секрецией инсулина . Инфузия антагонистов ГПП-1 бабуинам и грызунам приводила к повышению концентрации глюкозы в плазме крови натощак и к снижению концентрации инсулина после перорального введения глюкозы . Последнее наблюдение свидетельствует о том, что результатом нарушения действия ГПП-1 является снижение секреции инсулина и повышение уровня гликемии. Более того, помимо стимулирующего эффекта на процесс секреции инсулина, ГПП-1 также стимулирует биосинтез инсулина клеточными линиями островковых клеток invitro .
Регуляция уровня глюкозы натощак и после приема пищи
Уровень гликемии определяется скоростью поступления и скоростью элиминации глюкозы из кровяного русла. В основном концентрация глюкозы натощак поддерживается в пределах нормального диапазона (70–100 мг/дл, 3,8–5,6 ммоль/л) путем поддержания баланса между скоростью продукции глюкозы печенью и скоростью захвата глюкозы периферическими тканями.
В ответ на снижение концентрации глюкозы в плазме крови, имеющее место при голодании, a-клетками поджелудочной железы синтезируется глюкагон. Это способствует повышению поступления глюкозы в кровь (глюкоза образуется в печени путем глюконеогенеза и гликогенолиза), что поддерживает концентрацию глюкозы в плазме крови в пределах узкого физиологического диапазона.
Секреция ГПП-1 начинается после приема пищи в ответ на нейрогуморальные сигналы и присутствие пищи в кишечнике. Прием пищи повышает концентрацию глюкозы в крови, что совместно с секрецией ГПП-1 и ГИП стимулирует b-клетки, которые отвечают одновременной секрецией двух пептидных гормонов, регулирующих уровень глюкозы, - инсулина и амилина. ГПП-1 вызывает глюкозозависимую секрецию инсулина. Инсулин регулирует постпрандиальный уровень глюкозы, стимулируя поглощение глюкозы инсулиночувствительными тканями (печень, мышцы, жировая ткань), и таким образом обеспечивает элиминацию глюкозы. Кроме того, секреция инсулина подавляет секрецию глюкагона, приводя к снижению отношения «инсулин/глюкагон» и снижая продукцию глюкозы печенью.
Таким образом, ГПП-1 способствует поддержанию гомеостаза глюкозы и выполняет функции регулятора потребления пищи и поддержания b-клеток в здоровом состоянии. Инсулинотропное действие ГПП-1 ослабевает по мере снижения уровня глюкозы и приближения его к нормальным значениям, снижая таким образом вероятность развития гипогликемии .
Подавление секреции глюкагона
ГПП-1 подавляет секрецию глюкагона a-клетками поджелудочной железы в зависимости от уровня глюкозы. Этот эффект ГПП, подавляя секрецию глюкагона, приводит к уменьшению выработки глюкозы печенью. После приема пищи секреция ГПП-1 усиливает секрецию инсулина и подавляет секрецию глюкагона поджелудочной железой, тем самым эффективно усиливая подавление секреции глюкагона инсулином. В целом комбинация эффектов ГПП-1, совместно со стимулированной питательными веществами секрецией инсулина, регулирует постпрандиальный уровень глюкозы плазмы крови. Концентрация глюкозы в плазме крови натощак определяется балансом между поступлением глюкозы, индуцируемым глюкагоном, и ее элиминацией, стимулируемой инсулином. Соотношение между секрецией глюкагона и инсулина вносит значительный вклад в поддержание гомеостаза глюкозы в организме.
Регуляция опорожнения желудка
Одной из важных функций ГПП-1 является воздействие на скорость опорожнения желудка, что, в свою очередь, влияет на колебания уровня постпрандиальной глюкозы . Предполагается, что регуляция процесса опорожнения желудка под действием ГПП-1 осуществляется путем связывания ГПП-1 с рецепторами ГПП-1 в головном мозге, что ведет к парасимпатической стимуляции ветвями блуждающего нерва (n.vagus ) и регуляции процесса опорожнения желудка.
Кроме того, ГПП-1 снижает продукцию соляной кислоты в желудке, таким путем гарантируя адекватное ее количество в ответ на прием твердых компонентов пищи. Таким образом, ГПП-1 способствует регуляции переваривания содержимого желудка и уменьшает объем внутреннего просвета желудка . Общим результатом этого является ограничение постпрандиальных колебаний уровня глюкозы путем регулирования скорости поступления питательных веществ в тонкий кишечник.
Снижение потребления пищи и массы тела
ГПП-1 играет определенную роль в центральной регуляции потребления пищи.
С использованием различных моделей на животных было показано, что рецепторы ГПП-1, обнаруженные в различных отделах центральной нервной системы, в том числе в ядрах гипоталамуса и area postrema , вовлечены в процесс контроля потребления пищи.
Важно подчеркнуть, что для гипоталамических ядер и area postrema отсутствует гематоэнцефалический барьер, что позволяет ГПП-1 достигать этих областей из циркуляторного русла. Исследования показали, что введение ГПП-1 непосредственно в желудочки мозга грызунов приводит к дозозависимому снижению потребления пищи. Интравентрикулярное введение антагонистов ГПП-1, напротив, повышает потребление пищи, что приводит к увеличению массы тела .
Пролиферация и неогенез b-клеток поджелудочной железы
Интересным является тот факт, что ГПП-1 принимает участие в поддержании b-клеток поджелудочной железы в здоровом состоянии. Так, введение ГПП-1 здоровым крысам и мышам, а также старым глюкозотолерантным крысам приводило к усилению пролиферации и увеличению количества b-клеток в поджелудочной железе . В моделях на животных как in vivo , так и in vitro показано, что, помимо стимуляции пролиферации b-клеток у животных, ГПП-1 способствует образованию функционально активных b-клеток из недифференцированных панкреатических клеток-предшественников .
Механизм действия ГИП на панкреатические b-клетки изучен на различных моделях (в изолированных b-клетках, в перфузируемой поджелудочной железе, на интактных лабораторных животных). Дальнейшие исследования проводятся с использованием клонированных рецепторов с целью выявления активного сайта молекулы ГИП и механизмов клеточной активации в норме и при патологии. Так, выявлен еще один механизм, посредством которого ГИП может участвовать в регуляции дифференциации и митогенеза островковых клеток. Наряду с общеизвестным фактом нарушения секреции инсулина при ожирении и СД 2-го типа выявлено также снижение экспрессии рецепторов ГИП в b-клетках поджелудочной железы и соответствующее подавление передачи инкретинового сигнала. Этот факт объясняет снижение чувствительности к инкретинам при СД 2-го типа .
Таким образом, имеющиеся данные об основных свойствах гормонов-инкретинов ГПП-1 и ГИП свидетельствуют о важной роли этих гормонов, выделяемых клетками кишечника в ответ на прием пищи. Их воздействие осуществляется частично путем влияния на соотношение двух ключевых гормонов, вырабатываемых островковыми клетками поджелудочной железы, - инсулина и глюкагона, а также с помощью регуляции потребления пищи, продвижения химуса, пролиферации и дифференциации b-клеток. Эти кумулятивные эффекты, направленные на поддержание баланса между процессами образования и потребления клетками глюкозы, играют определяющую роль в регуляции гомеостаза глюкозы в организме.
2. Лекарственные средства, усиливающие эффекты инкретинов, и их применение при сахарном диабете 2-го типа
Механизмы действия ингибиторов ДПП-4
При СД 2-го типа действие инкретина нарушается, но экзогенно введенный ГПП-1 может нормализовать концентрации как натощак, так и после еды . Показано, что ГПП-1 при длительном подкожном введении больным СД 2-го типа (в течение 6 недель) улучшал функцию b-клеток, снижал уровень глюкозы и гликозилированного гемоглобина (HbA1c), повышал периферическую инсулиночувствительность; кроме того, зафиксировано снижение массы тела .
Однако период циркуляции эндогенного или экзогенного ГПП-1 в крови, как уже отмечалось, чрезвычайно мал в связи с быстрой инактивацией инкретинов под действием фермента дипептидилпептидазы-4, отвечающего за начальный быстрый распад ГПП-1 и ГИП .
Для обеспечения возможности практического использования нативного ГПП-1 как нового средства в терапии СД 2-го типа целесообразным является предотвращение быстрого распада ГПП-1 с применением ингибиторов ДПП-4. Реальность этого подхода доказана в ходе доклинических исследований ингибиторов ДПП-4 с использованием моделей инсулинорезистентности, СД 2-го типа, нарушенной толерантности к глюкозе на животных, в которых было показано, что рост концентрации интактного гормона инкретина сопровождается улучшением толерантности к глюкозе (рис. 1).
Использование ингибиторов ДПП-4, на фоне приема которых достигается повышение содержания ГПП-1, представляет собой действительно физиологический путь восстановления нарушенной глюкозозависимой секреции инсулина и коррекции повышенного уровня глюкагона - ключевых расстройств, которые характерны для сахарного диабета.
Кроме того, ингибиторы ДПП-4 проявляют в эксперименте противоопухолевую активность, действуя путем стимуляции продукции цитокинов и хемокинов на транскрипционном уровне. При этом в пределах новообразований и лимфатических узлов в системе регионарного оттока развиваются адаптивный и генетически предетерминированный варианты иммунного ответа, которые обусловливают мощный антинеопластический эффект в отношении ряда опухолевых моделей у мышей .
Миметики инкретина
По механизму действия ингибиторы ДПП-4 имеют много общего с другим новым классом антидиабетических препаратов - так называемыми миметиками инкретина. Указанные средства также имитируют естественные физиологические механизмы обеспечения адекватного контроля гликемии. Первым средством этой группы стал препарат баета (Byetta). Действующим веществом этого препарата является экзенатид (синтетический экзендин-4). Баета была одобрена Управлением по контролю за продуктами и лекарствами (FDA) США в апреле 2005 г.
Экзенатид является синтетическим аналогом протеина, который содержится в слюне гигантской ящерицы Gila Monster, обитающей в юго-западных районах США. Это вещество помогает пресмыкающемуся, которое питается очень редко, но обильно, избегать резких перепадов концентрации глюкозы крови и поддерживать сравнительно стабильный ее уровень.
Как свидетельствуют результаты нескольких клинических исследований, парентеральное введение экзенатида обеспечивает надежный контроль гликемии (снижение содержания глюкозы в крови как натощак, так и после приема пищи) даже у тех пациентов с сахарным диабетом 2-го типа, у которых другие существующие пероральные антидиабетические средства оказываются недостаточно эффективными, даже в максимальных терапевтических дозах. Кроме того, на фоне применения препарата отмечается еще один благоприятный терапевтический эффект- дозозависимое снижение массы тела . Есть также основания полагать, что экзенатид является прямым стимулятором неогенеза b-клеток поджелудочной железы .
Разрабатываются и проходят испытания синтетические инъекционные аналоги ГПП-1, которые благодаря некоторым отличиям своей структуры от нативного ГПП-1 обладают более длительным периодом полужизни .
При создании ингибиторов ДПП-4 был использован другой путь: воздействуя на фермент, деградирующий ГПП-1, данные препараты повышают эндогенные уровни гормона ГПП-1, не прибегая к экзогенному введению синтетических инкретинов. Кроме того, в отличие от экзенатида, который вводится парентерально, ингибиторы ДПП-4 созданы в виде твердых лекарственных форм для приема внутрь.
Онглиза (саксаглиптин) - новый препарат из группы ингибиторов ДПП-4
В настоящее время для лечения СД 2-го типа одобрены несколько препаратов из группы ингибиторов ДПП-4. Ситаглиптин компании «Мерк» получил одобрение Управления по контролю за продуктами и лекарствами США в октябре 2006 года и Европейского агентства по лекарственным средствам в марте 2007 года, а вилдаглиптин компании «Новартис» был одобрен Европейским агентством по лекарственным средствам в июле 2007 года. Значительное число других компаний, включая «РОШ» и «НовоНордиск», проводят доклинические и клинические испытания потенциальных ингибиторов ДПП-4. В 2009 году вышел на рынок препарат Онглиза (саксаглиптин).
Онглиза (саксаглиптин) (BMS-477118; (S)-3-гидроксиадамантилглицин-L-cis-4,5-метанопролинни-трил) - нитрилсодержащий ингибитор ДПП-4 (рис. 2) с молекулярной формулой C18H27N3O3 и молекулярной массой 333,4. Это мощный селективный, обратимый конкурентный ингибитор ДПП-4 с константой ингибирования К = 0,6–1,3 нмоль/л, что отражает медленную связывающую способность. По данным фармакокинетического исследования полагают, что ингибирование ДПП-4 Онглизой (саксаглиптином) - двухэтапный процесс, включающий образование обратимого ковалентного комплекса «фермент - ингибитор» и диссоциацию ингибитора, в результате чего фермент медленно балансирует между активной и неактивной формой .

Онглиза (саксаглиптин) легко всасывается после перорального приема. Максимальный уровень в крови Онглизы (саксаглиптина) и его основного метаболита достигается через 2 и 4 часа соответственно. Одновременный с препаратом прием пищи слабо влияет на фармакокинетические показатели Онглизы (саксаглиптина). Связывания Онглизы (саксаглиптина) и его метаболитов с белками крови практически не наблюдается, поэтому изменение концентрации белков в плазме при некоторых состояниях (печеночная или почечная недостаточность) не оказывает влияния на распределение Онглизы (саксаглиптина).
Введение Онглизы (саксаглиптина) пациентам с СД 2-го типа вызывает ингибирование ДПП-4 в течение 24 часов. После нагрузки глюкозой это ведет к увеличению уровня активных циркулирующих инкретинов (в том числе ГПП-1 и ГИП) в 2–3 раза, в результате отмечается повышение концентраций инсулина и С-пептида и снижение уровня глюкагона.
Онглиза (саксаглиптин) метаболизируется in vitro до формы активного метаболита (BMS-510849), активность которого вдвое ниже, чем исходной молекулы. Эта биотрансформация происходит с участием системы цито-хрома Р450 3А4/5 (CYP3А4/5) в печени. При печеночной недостаточности концентрация метаболита в крови уменьшается (на 7–33 %). И Онглиза (саксаглиптин), и ее первичный метаболит являются сильными ингибиторами активности ДПП-4 в плазме крови мышей, крыс, собак, яванских макак, макак-резус и человека in vitro .
Онглиза (саксаглиптин) и ее метаболит выводится из организма как почками, так и печенью. Средний почечный клиренс Онглизы (саксаглиптина) (около 230 мл/мин) выше, чем обычный уровень почечной фильтрации (около 120мл/мин), что свидетельствует о ее активной экскреции почками. Около 22 % введенной меченной С14Онглизы (саксаглиптина) обнаруживалось в фекалиях, частично экскретируясь с желчью, а частично представляя собой неабсорбированный исходный продукт.
Результаты клинического исследования саксаглиптина в сочетании с другими сахароснижающими средствами
Комбинированная схема для первичного лечения Онглизой (саксаглиптином) и метформином была изучена в исследовании, которое длилось 24 недели и в которое были включены 1306 ранее не леченных пациентов с плохо контролируемым СД 2-го типа (исходный уровень HbA1c = 9,5 %) . Пациенты были рандомизированы в группы монотерапии метформином или Онглизой (саксаглиптином) (10 мг) или комбинированной терапии Онглизой (саксаглиптином) (5 или 10 мг) и метформином (начиная с 500 мг в день с повышением до 2000 мг в день). Комбинированное лечение оказалось более эффективным, чем оба вида монотерапии: обе дозы Онглизы (саксаглиптина) в сочетании с метформином снижали уровень HbA1c на 2,5 % от исходного показателя, в то время как монотерапия Онглизой (саксаглиптином) - всего на 1,7 %, а метформином - на 2,0 %.
В рандомизированном плацебо-контролируемом двойном слепом исследовании с участием 743 пациентов с СД 2-го типа с неадекватным гликемическим контролем (HbA1c = 8 %), получавших монотерапию метформином (более 1500 мг/день), добавление Онглизы (саксаглиптина) как дополнительного лечения (курсом 24 недели в дозе 2,5; 5 или 10 мг/день) снижало уровень HbA1c на 0,7%; 0,8 % и 0,7% соответственно.
На рис. 3 наглядно представлены результаты этого исследования, которые демонстрируют дополнительные положительные эффекты при добавлении Онглизы (саксаглиптина) к лечению метформином: снижение уровня глюкозы натощак (на 1,33 ммоль/л по сравнению с плацебо) и постпрандиально, что привело к заметному снижению HbA1c; колебания постпрандиального уровня глюкозы были значительно реже. Не обнаружено статистически достоверного изменения массы тела пациентов после курса Онглизы (саксаглиптина), как и учащения проявлений гипогликемии по сравнению с группой плацебо .

В другом 24-недельном исследовании, включавшем 768 пациентов с СД 2-го типа с недостаточным контролем при помощи субмаксимальных доз глибенкламида (HbA1c=8,4%), после приема глибенкламида в течение 4 недель в дозе 7,5 мг в одной группе больных дополнительно назначалась Онглиза (саксаглиптин) (2,5 или 5,0мг/день), а в другой - увеличивалась доза глибенкламида до разрешенного максимума (15 мг/день). Онглиза (саксаглиптин) в обеих дозировках повышала эффективность лечения по сравнению с увеличенной дозой глибенкламида: HbA1c снижался на 0,5–0,6 % от исходного уровня, при этом примерно у 22 % пациентов был достигнут целевой уровень HbA1c (ниже 7 %) по сравнению с группой глибенкламида, в которой HbA1c повысился на 0,1 %. Добавление Онглизы (саксаглиптина), в отличие от повышения дозы глибенкламида, улучшило показатели гликемии натощак и после еды, а также увеличило реакцию b-клеток на глюкозу .
52-недельное исследование , в котором участвовало 858 взрослых больных СД 2-го типа, принимавших более 1500 мг/день метформина и имевших при этом уровень HbA1c более 6,5–10 %, показало, что добавление к этому лечению 5 мг/день Онглизы (саксаглиптина) привело к снижению HbA1c на 0,74 %, что сопоставимо со снижением HbA1c на 0,80 % в группе, в которой к монотерапии метформином добавляли глипизид в средней суточной дозе 14,7 мг/день. Межгрупповая разница составила 0,06% (95% доверительный интервал от –0,05 до 0,16 %). Дополнительное лечение Онглизой (саксаглиптином) сопровождалось снижением массы тела по сравнению с глипизидом (соответственно –1,1 кг и +1,1кг; p< 0,0001) и ощутимо меньшей частотой гипогликемий (3,0 vs. 36,3 %; p < 0,0001) без эпизодов тяжелой гипогликемии в группе Онглизы (саксаглиптина). Кроме случаев гипогликемии, частота других нежелательных эффектов, связанных с лечением, была значительно ниже у больных, получавших Онглизу (саксаглиптин) (9,8%), чем у принимавших глипизид (31,2 %).
В исследовании Онглизу (саксаглиптин) добавляли к лечению тиазолидиндионами (ТЗД) у 565 больных (исходный HbA1c = 8,3 %) при неадекватно контролируемой гипергликемии на фоне монотерапии стабильными дозами ТЗД (пиоглитазон - 30 или 45 мг, розиглитазон- 4 или 8 мг, курсом более 12 недель). Добавление 2,5 или 5,0мг/день Онглизы (саксаглиптина) через 24 недели привело к более выраженному снижению уровня HbA1c (–0,7 или –0,9 %) по сравнению с группой плацебо (–0,3%). Целевой уровень HbA1c был достигнут у 42% пациентов, получавших Онглизу (саксаглиптин), и только у 26 % в контрольной группе. Уровень гликемии натощак и постпрандиально (рис. 4), а также показатель НОМА-2 (оценка функции b-клеток) в группе Онглизы (саксаглиптина) улучшался, тогда как в группе сравнения не изменялся.

Недавно опубликованы результаты первого параллельного исследования , в котором проведено сравнение эффективности комбинации с метформином двух ингибиторов ДПП-4: Онглизы (саксаглиптина) и ситаглиптина в лечении пациентов с СД 2-го типа, у которых метформин не обеспечивал адекватного контроля гликемии. Пациенты с уровнем гликозилированного гемоглобина 6,5–10 % при постоянной дозе метформина 1500–3000 мг/сутки были рандомизированы на группы, которые получали дополнительно к метформину 5 мг Онглизы (саксаглиптина) (n=403) или 100 мг ситаглиптина (n = 398) 1 раз в день. Через 18 недель лечения разница исходных и конечных уровней HbA1c у больных, получавших Онглизу (саксаглиптин) или ситаглиптин, составила соответственно –0,52 и –0,62 % (межгрупповое различие 0,09%; 95% доверительный интервал - от 0,01 до 0,20%), что расценивается как сопоставимость результатов. Доля пациентов, достигших за время лечения терапевтического гликемического ответа (уровня HbA1c ≤ 6,5 %), была близкой в двух группах больных, составив 26,3 % при лечении Онглизой (саксаглиптином) и метформином и 29,1% при использовании ситаглиптина и метформина. Оба вида лечения хорошо переносились больными, частота и тяжесть нежелательных последствий были сравнимы в двух группах. Случаи гипогликемии, в основном легкой степени, отмечены примерно у 3 % пациентов каждой группы. Снижение массы тела в обеих группах составило около 0,4 кг. В группах, получавших Онглизу (саксаглиптин) или ситаглиптин, не выявлено различий в частоте проявления таких наиболее обычных явлений, как инфекции мочевого тракта (5,7 и 5,3 %), назофарингиты (4,0 и 4,0 %), диарея (2,5 и 2,5 %). Таким образом, исследование продемонстрировало сопоставимые результаты эффективности комплексного применения Онглизы (саксаглиптина) и ситаглиптина с метформином в плане улучшения гликемического контроля, безопасности и переносимости лечения. Следует подчеркнуть, что аналогичный терапевтический эффект достигался при дозе Онглизы (саксаглиптина) 5 мг и ситаглиптина 100 мг, что указывает на меньшую нагрузку ферментных и транспортных систем печени и почек при длительном приеме Онглизы (саксаглиптина) по сравнению с ситаглиптином. Следует отметить, что Онглизу (саксаглиптин) можно назначать в неизменной дозе 5 мг в сутки у пациентов с легкой и умеренной степенью печеночной недостаточности.
Онглиза (саксаглиптин) - единственный ингибитор ДПП-4, который можно назначать пациентам с умеренной и тяжелой степенью почечной недостаточности в дозе 2,5 мг в сутки. Применять другие ингибиторы ДПП-4, которые используются в рутинной клинической практике в настоящее время, не рекомендуется.
Безопасность и переносимость Онглизы (саксаглиптина)
Важным преимуществом антидиабетических средств из группы ингибиторов ДПП-4 является хороший профиль безопасности. Судя по данным клинических исследований, Онглиза (саксаглиптин) хорошо переносится пациентами. Не было отмечено нежелательных явлений после приема препарата, что подтверждено результатами лабораторных анализов после 2 недель приема Онглизы (саксаглиптина) в дозе до 40 мг; применение препарата также не отражалось на параметрах QT-интервала на электрокардиограмме .
Случаи гипогликемии встречались редко. В исследованиях с применением различных доз препарата не было отмечено явных дозозависимых побочных эффектов. Частота и спектр нежелательных явлений сходны с таковыми в контрольных группах (плацебо). Наиболее часто встречались: головная боль, инфекции верхних дыхательных путей и органов мочевыделения, назофарингиты. Не отмечено влияния на количество лимфоцитов или конкретно нейтрофилов, негативного влияния на иммунитет. В результатах прочих лабораторных исследований, включая проверку функции печени, отклонения не обнаружены .
Онглиза (саксаглиптин) также хорошо переносится в составе комбинированной терапии. Не обнаружено достоверных отличий в частоте и характере нежелательных явлений при использовании Онглизы (саксаглиптина) в комбинации с метформином, глибенкламидом и ТЗД по сравнению с контрольными группами больных .
Гипогликемия
При терапевтических дозировках Онглизы (саксаглиптина) до 10 мг в проведенных исследованиях не отмечено повышения частоты гипогликемии по сравнению с плацебо. При монотерапии симптомы гипогликемии проявлялись у 6,3 % пациентов, принимавших Онглизу (саксаглиптин) в малых дозах (2,5–40,0 мг), против 1,5 % пациентов группы плацебо и 13,6 % лиц, принимавших высокие дозы Онглизы (саксаглиптина) (100 мг) .
При комбинации Онглизы (саксаглиптина) с глибенкламидом гипогликемия встречалась у 14 % пациентов, что сравнимо с результатами группы при восходящем титровании глибенкламида (10 %) . Низкая частота гипогликемии отмечена при сочетании Онглизы (саксаглиптина) с ТЗД (4,1 и 2,7 % для доз 2,5 и 5,0 мг соответственно) по сравнению с 3,8 % при монотерапии ТЗД, и только один случай гипогликемии подтвержден в группе Онглизы (саксаглиптина) 2,5 мг .
Таким образом, появление новых антидиабетических препаратов, действие которых основано на усилении эффекта эндогенных инкретинов, открывает новые перспективы в лечении СД 2-го типа. Несмотря на то что 2 класса этих препаратов (ингибиторы ДПП-1 и аналоги ГПП) относятся к химически различным и структурно независимым соединениям, они имеют сходный механизм действия, заключающийся в регулировании гомеостаза глюкозы путем воздействия на процессы глюкозозависимого синтеза инсулина и глюкагона, влияния на потребление пищи и продвижение химуса, на пролиферацию и дифференциацию b-клеток поджелудочной железы. Существенным преимуществом ингибиторов ДПП-4 является возможность их использования в таблетированной форме в отличие от инъекционных аналогов ГПП. Важно также то, что ингибиторы ДПП-4не вызывают существенных побочных эффектов, не повышают частоту гипогликемии и не приводят к увеличению массы тела. Ингибиторы ДПП-4 эффективны как в виде монотерапии, так и в сочетании с метформином, производными сульфонилмочевины, ТЗД. В большинстве проведенных исследований добавление ингибитора ДПП-4 Онглизы (саксаглиптина) обеспечивало дополнительное снижение уровня гликозилированного гемоглобина, сопоставимое с использованием дополнительных сахароснижающих средств других групп. Это особенно актуально в случаях, когда максимально возможные дозы сахароснижающих препаратов не обеспечивают адекватного контроля гликемии у пациента. Проведение новых широких исследований возможностей применения ингибиторов ДПП-4 поможет этому классу препаратов занять стабильное место в стратегии лечения СД 2-го типа.
Литература1. Ahren B. New strategy in type 2 diabetes tested in clinical trials. Glucagon-like peptide 1 (GLP-1) affects basic caused of the disease// Lakartidningen. - 2005. - 102 (8). - 545-549.2. Ahren B., Pacini G., Foley J., Schweizer A. Improved meal-related (beta)-cell function and insulin sensitivity by the dipeptidyl peptidase-iv inhibitor vildagliptin in metformin-treated patients with type 2 diabetes over 1 year // Diabetes Care. - 2005. - 28 (8). - 1936-1940.3. Ahren B., Schmitz O. GLP-1 receptor agonists and DPP-4 inhibitors in the treatment of type 2 diabetes // Horm. Metab. Res. - 2004. - 36 (11–12). - 867-876.4. Baggio L., Kieffer T., Drucker D. Glucagon-like peptide-1, but not glucose-dependent insulinotropic peptide, regulates fasting glicemia and nonenteral glucose clearance in mice // Endocrinology.- 2000.- 141. - 3703-3709.5. Boulton D., Grealdes M. Safety, tolerability, pharmacokinetics and pharmacodynamics of once-daily oral doses of saxagliptin in type 2 diabetic and healthy subjects // Diabetes. - 2007. - 56 (S1). - A161.6. Brandt I., Joossens J., Chen X. et al. Inhibition of dipeptidyl-peptidase IV catalyzed peptid truncation by Vildagliptin ((2S)-(((3-hydroxyadamantan-1-yl)amino) acetyl)-pyrrolidine-2-carbonitrile)// Biochem. Pharmacol. - 2005. - 70 (1).- 134-143.7. Chang X., Keller D., Bjorn S., Led J. Structure and folding of glucagon-like peptide-1-(7-36)-amide in trifluoroethanol studied by NMR // Mag. Reson. Chem. - 2001. - 39. - 477.8. Deacon C., Holst J. Saxagliptin: a new dipeptidil peptidase-4 inhibitor for the treatment of type 2 diabetes // Adv. Ther. - 2009. - 26 (5). - 488-499.9. DeFronzo R., Hissa M., Blauvet M., Chen R. Saxagliptin added to metformin improves glicemic control in patients with type 2 diabetes // Diabetes. - 2007. - 56 (S1). - A74.10. DeFronzo R., Ratner R., Han J. et al. Effects of exenatide (exendin-4) on glycemic control and weight over 30 weeks in metformin-treated patients with type 2 diabetes // Diabetes Care. - 2005. - 28 (5). - 1092-1100.11. Drucker D. Glucagon-like peptides: regulators of cell proliferation, differentiation, and apoptosis // Mol. Endocrinol. - 2003.- 17. - 161-171.12. Drucker D. Minireview: The glucagon-like peptides // Endocrinology. - 2001. - 142. - 521-527.13. Drucker D., Philippe J., Mojsov S. et al. Glucagon-like peptide-1 stimulates insulin gene expression and increases cyclic FMP levels in a rat islet cell line // Proc. Natl Acad. Sci. USA. - 1987.- 84. - 3434-3438.14. Duttaroy A., Voelker F., Merriam K. et al. The DPP-4 inhibitor vildagliptin increases pancreatic beta cell neogenesis and decreases apoptosis // Program and abstracts of the 65th Scientific Sessions of the American Diabetes Association; June 10–14, 2005; SanDiego, California. Abstract 572-P.15. Elrick H., Stimmler L., Hlad C., Arai Y. Plasma insulin response to oral and intravenous glucose administration // J. Clin. Endocrinol. Metab. - 1964. - 24. - 1076-1082.16. Flamez D., Van Breusengem A., Scrocchi L. et al. Mouse pancreatic beta-cells exhibit preserved glucose competence after disruption of the GLP-1 glucagon-like peptide-1 receptor gene // Diabetes. - 1988. - 47. - 646-652.17. Goke R., Wagner B., Fehmann H., Goke B. Glucosodependency of the insulin stimulatory effect on glucagon-like peptide-1(7-36)amide on the rat pancreas // Res. Exp. Med. (Berl.).- 1993. - 193.- 97-103.18. Hansen P., Corbett J. Incretin hormones and insulin sensiti-vity // Trends Endoc. Metab. - 2005. - 16(4). - 135-136.19. Henry J., Han R. Effects of exenatide (exendin-4) on glycemic control over 30 weeks in sulfonylurea-treated patients with type 2 diabetes // Diabetes Care. - 2004. - 27 (11). - 2628-2635.20. Hollander P., Allen E., Chen J. Saxagliptin added to thiazolidindione improves glicemic control in patients with type 2 diabetes inadequate control on thiasolidinedione alone // J. Clin. Endocr. Metab. - 2009. - 94 (12). - 4810-4819.21. Holst J., Gromada J. Role of incretin hormones in the regulation of insulin secretion in diabetic and nondiabetic humans // Am. J. Phisiol. Endocrinol. Metab. - 2004. - 287. - E199-E206.22. Holz G., Kuhtreiber W., Habener J. Pancreatic beta-cells are rendered glucose-competent by the insulinotropic hormone glucagon-like peptide-1 (7-37) // Nature. - 1993. - 361. - 646-652.23. Jadinsky M., Pfutzner A., Paz-Pacheco E. Saxagliptin given in combination with metformin in patients with type 2 diabetes, compared with either monotherapy: a randomised controlled trial // Diabetes Obes. Metab. - 2009. - 10. - 110-115.24. Keating G. Exenatide // Drugs. - 2005. - 65 (12). - 1681-1692.25. Kendall D., Riddle M., Rosenstock J. et al. Effects of exenatide (exendin-4) on glycemic control over 30 weeks in patients with type 2 diabetes treated with metformin and a sulfonylurea // Diabetes Care. - 2005. - 28(5). - 1083-1091.26. Kirby M., Yu D., O’Connor S., Gorrell M. Inhibitor selectivity in the clinical application of dipeptidyl peptidase-4 inhibition //Clin. Sci. - 2010. - 118. - 31-41.27. Mari A., Sallas W., He Y. et al. Vildagliptin, a dipeptidyl peptidase-4 inhibitor, improves model-assessed (beta)-cell function in patients with type 2 diabetes // J. Clin. Endocrinol. Metab. - 2005. - 90 (8). - 4888-4894.28. Nauck M., Heimesaat M., Orskov C. et al. Preserved incretin activity of glucagon-like peptide-1 amide but not not synthetic human gastric inhibitory polypeptide in patients with type 2 diabetes mellitus // J. Clin. Invest. - 1993. - 91. - 301-307.29. Nauck M., Homberger F., Siegel E. et al. Incretin effects of increasing glucose loаds in man calculated from venous insulin and C-peptide responses // J. Clin. Endocrinol. Metab. - 1986. - 63.- 492-498.30. Nauck M., Meier J. Glucagon-like peptide 1 and its derivates in the treatment of diabetes // Regul. Pept. - 2005 Jun 15. - 128(2).- 135-48.31. Perfetti R., Zhou J., Doyle M., Egan J. Glucagon-like peptide-1 induces cell proliferation and pancreatic-duodenum homeobox-1 expression and increases endocrine cell mass in the pancreas of old, glucose-tolerant rats // Endocrinology. - 2000. - 141. - 4600-4605.32. Perley M., Kipins D. Plasma insulin responces to oral and intravenous glucose: studies in normal and diabetic subjects // J. Clin. Invest. - 1967. - 46. - 1954-1962.33. Poon T., Nelson P., Shen L. et al. Exenatide improves glycemic control and reduces body weight in subjects with type 2 diabetes: a dose-ranging study // Diabetes Technol. Ther. - 2005. - 7 (3).- 467 -477.34. Ravichandran S., Chacra A., Tan G. et al. // Diabetologia.- 2008. - 51 (S1). - S342.35. Rosenstock J., Aguilar-Salinas C., Klein E. et al. Once-daily saxagliptin monotherapy improves glycemic in drug-naive patients with type 2 diabetes // Diabetes Obes. Metab. - 2008. –10. - 376-386.36. Schjoldager B., Mortensen P., Christiansen J. et al. GLP-1 (glucagon-like peptide-1) and truncated GLP-1, fragments of human proglucation, inhibit gastric acid secretion in humans // Dig. Dis. Sci.- 1989. - 34. - 703-708.37. Turton M., O’Shea D., Gunn I. et al. A role of glucagon-like peptide-1 in the central regulation of feeding // Nature. - 1996. - 379. - 69-72.38. Young A., Gedulin B., Rink T. Dose-responces for slowing of gastric emptying in a rodent model by glucagon-like peptide (7-36)NH2, amilin, cholecystokinin, and other possible regulators of nutrient uptake // Metabolism. - 1996. - 45. - 1-3.39. Zander M., Madsbad S., Madsen J., Holst J. Effect of 6-week course of glucagon-like peptide-1 on glicaemic control, insulin sensitivity, and beta-cell function in type 2 diabetes: a parallel-group study// Lancet. - 2002. - 359. - 824-830.40. Gцke B., Gallwitz B., Eriksson J., Hellqvist A., Gause-Nilsson I. Saxagliptin is non-inferior to glipizide in patients with type 2 diabetes inadequately controlled on metformin alone: a 52-week randomized controlled trial // J. Clin. Pract. - 2010. - 64 (12). - 1619-1631.41. Sheen A.J., Charpentier C.J., Ostgren A.H., Gause-NilssonI. Efficacy and safety of saxagliptin in combination with metformin compared with sitagliptin in combination with metformin in adult patients with type 2 diabetes mellitus // Diab. Metab. Res. Rev. - 2010. - 26 (7). – 540-549.
Для цитирования:
Аметов А.С., Карпова Е.В. Клиническое использование ингибитора ДПП–4 – вилдаглиптина при сахарном диабете 2 типа // РМЖ. 2010. №14. С. 887
В последние годы большой научно-практический интерес вызывает изучение роли гормонов желудочно-кишечного тракта в регуляции секреции инсулина, а следовательно, и в регуляции гомеостаза глюкозы в организме человека. Из них более или менее известна роль глюкагоноподобного пептида 1 (ГПП-1) и глюкозозависимого инсулинотропного полипептида (ГИП), которые получили название инкретины. Инкретины - это гормоны желудочно-кишечного тракта, вырабатываемые в ответ на прием пищи и вызывающие стимуляцию секреции инсулина. А их действие, приводящее к усилению глюкозозависимой секреции инсулина β-клетками поджелудочной железы, было названо «инкретиновый эффект» (рис. 1).
В последние годы большой научно-практический интерес вызывает изучение роли гормонов желудочно-кишечного тракта в регуляции секреции инсулина, а следовательно, и в регуляции гомеостаза глюкозы в организме человека. Из них более или менее известна роль глюкагоноподобного пептида 1 (ГПП-1) и глюкозозависимого инсулинотропного полипептида (ГИП), которые получили название инкретины. Инкретины - это гормоны желудочно-кишечного тракта, вырабатываемые в ответ на прием пищи и вызывающие стимуляцию секреции инсулина. А их действие, приводящее к усилению глюкозозависимой секреции инсулина
β
-клетками поджелудочной железы, было названо «инкретиновый эффект» (рис. 1).
«Инкретиновый эффект» был впервые описан двумя независимыми исследовательскими группами (McIntyre, Elrick) еще в 1964 году и трактовался, как характеристика действия пептидных гормонов, которые секретируются К- и L-клетками кишечника в ответ на прием пищи. С его помощью можно объяснить механизм стимуляции выработки инсулина в ответ на прием пищи. Необходимо отметить, что наиболее изученным из группы инкретинов в настоящее время является ГПП-1. Поскольку период полужизни ГПП-1 очень короткий, в клинической практике его невозможно использовать в качестве натурального препарата. В связи с этим было предложено ингибирование фермента дипептидилпептидазы-4 (ДПП-4), разрушающего естественные инкретины организма.
Хорошо известно, что ДПП-4 относится к классу сериновых протеаз, представителей которых много в организме человека. Основная функция фермента заключается в быстрой инактивации олигопептидов в разных тканях и органах, путем отделения двух аминокислот от N-окончания. Пептиды-мишени для ДПП-4 находятся в кишечнике - ГПП-1 и ГИП.
Изучено, что фермент ДПП-4 быстро инактивирует ГПП-1 и ГИП сразу после их секреции в кишечнике. Однако при ингибировании ДПП-4 уровень и активность инкретинов повышается, а их действие продлевается (рис. 2).
При ингибировании ДПП-4 активность инкретинов продлевается, что, в свою очередь, повышает уровень активных инкретинов в циркуляции крови. В результате дисбаланс соотношения инсулин/глюкагон нормализуется: глюкозозависимая инсулиновая секреция
β
-клетками повышается, а секреция глюкагона
α
-клетками подавляется, что позволяет эффективно контролировать гликемический контроль на фоне значительного снижения риска гипогликемий, особенно тяжелых эпизодов, за счет глюкозочувствительного действия . Улучшение функции островковых клеток приводит к улучшению гликемического контроля (рис. 3).
Таким образом, ингибиторы ДПП-4 являются новым классом сахароснижающих препаратов, основное действие которых нацелено на повышение активности собственных инкретинов организма и которые, судя по всему, обеспечивают лучшее соотношение преимущество/риск по сравнению с другими классами препаратов для лечения сахарного диабета 2 типа. Данные многочисленных международных исследований подтвердили, что препараты ингибиторов ДПП-4 повышают уровень эндогенного инсулина, снижают уровень глюкагона в плазме крови и подавляют глюконеогенез в печени, уменьшают инсулинорезистентность, обеспечивая полноценный гликемический контроль.
В настоящее время ингибиторы ДПП-4 являются чрезвычайно перспективным, активно развивающимся классом сахароснижающих препаратов для лечения сахарного диабета 2 типа. Одним из представителей данного класса является вилдаглиптин (Галвус).
В ходе международных клинических исследований с участием свыше 22 тыс. больных сахарным диабетом 2 типа и нарушенной толерантностью к глюкозе показана эффективность вилдаглиптина при применении его как в виде монотерапии, так и в комбинации с другими сахароснижающими средствами. Одним из основных преимуществ этих препаратов является возможность их применения в группах пожилых пациентов, пациентов с гипертензией и нарушением почечной функции средней тяжести, пациентов группы сердечно-сосудистого риска. Вилдаглиптин можно комбинировать с любым сахароснижающим препаратом, в том числе и с инсулином .
Монотерапия вилдаглиптином
S. Dejager и соавт. (2007) изучали эффективность препарата в ходе плацебо-контролируемого исследования длительностью 24 недели с участием 632 пациентов. После рандомизации в основной группе больные получали вилдаглиптин по 50 мг 2 раза в сутки либо по 50-100 мг однократно. По сравнению с исходными данными показатели HbA1c снизились соответственно на 0,7±0,1%; 0,8±0,2% и 0,9±0,1% (рис. 4).
Кроме того, в основной группе отмечено снижение массы тела соответственно на -1,8, - 0,3 и - 0,8 кг; на фоне плацебо вес снизился на 1,4 кг. Зарегист-ри-ро-вано 3 случая гипогликемии легкой степени тяжести у пациентов, получавших вилдаглиптин.
В другом исследовании в течение 52 недель сравнивались результаты лечения вилдаглиптином (по 50 мг 2 р/сут., n=526) или метформином (по 1000 мг 2 р/сут., n=254) больных сахарным диабетом 2 типа при исходных средних значениях гликированного гемоглобина 8,7%. Динамика гликированного гемоглобина в ходе исследования составила - 1,0% в основной группе, что было статистически значимо по сравнению со стартовыми показателями, однако без преимущества по сравнению с метформином (динамика уровня гликированного гемоглобина в группе контроля составила 1,4%).
Помимо этого, исследование, проведенное Shweizer A. и соавт. , показало, что при старте медикаментозной терапии назначение препарата Галвус в сравнении с метформином обеспечивает достоверное, клинически значимое и дозозависимое снижение уровня HbA1c на 1,1% при дозе 50 мг 2 раза в сутки. При этом существенно снизилась частота желудочно-ки-шечных побочных явлений в группе терапии вилдаглиптином в сравнении с терапией метформином оказалась значительно менее выраженной (рис. 5). Масса тела у пациентов обеих групп оставалась стабильной с тенденцией к снижению. Таким образом, вилдаглиптин является альтернативой метформину при старте терапии диабета .
В исследовании Rosenstock J. с соавт. было показано, что вилдаглиптин является и альтернативой тиазолидиндионам при старте терапии сахарного диабета. Галвус обеспечил аналогичное снижение уровня HbA1c как и росиглитазон на 0,9%. При этом через 24 недели разница в динамике массы тела на терапии росиглитазоном и вилдаглиптином составила 2,8 кг, с повышением веса в среднем на 1,6-1,7 кг в группе терапии роси-глитазоном и снижением на 0,3-1,1 кг в группе терапии вилдаглиптином. Кроме того, терапия вилдаглиптином не связана с развитием отеков и остеопороза, и ее можно назначать пациентам из группы сердечно-сосудистого риска . Таким образом, Галвус является альтернативой тиазолидиндионам при старте и продолжении терапии сахарного диабета 2 типа (рис. 6).
Работы с применением вилдаглиптина в виде монотерапии показали, что его эффективность возрастает по мере увеличения исходных показателей уровня гликированного гемоглобина. Также установлено, что результативность лечения не зависит от возраста и степени ожирения. В среднем уровень гликемии натощак снижается на 1,0 ммоль/л, постпрандиальной - на 1,0-1,5 ммоль/л.
Комбинация вилдаглиптина
с препаратами сульфонилмочевины
В клинических исследованиях вилдаглиптин был эффективен и хорошо переносился пациентами с сахарным диабетом 2 типа, находящимися на терапии препаратами сульфонилмочевины. Комбинированная терапия вилдаглиптина и глимеперида приводила к снижению уровня HbA1с на 0,7±0,1% по сравнению с монотерапией глимеперидом. Помимо этого, необходимо отметить: на фоне данной комбинированной терапии не зафиксировано повышения массы тела у пациентов, что также ассоциировалось с минимальным риском развития эпизодов гипогликемии .
Комбинация вилдаглиптина
с инсулином
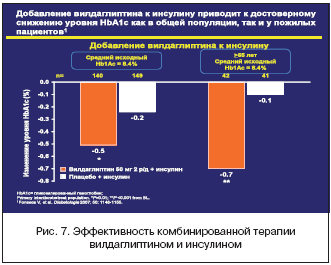
V. Fonseca и соавт. в одной из своих научных работ (2006) изучали эффективность добавления вилдаглиптина (50 мг в сутки) к инсулину (средняя суточная доза составляла 82 ед) у 256 больных с неудовлетворительными показателями углеводного обмена (исходно уровень гликированного гемоглобина в среднем составлял 8,4%) в течение 24 недель. Важно отметить, что на протяжении периода исследования режим инсулинотерапии у пациентов не менялся. К концу наблюдения значения уровня гликированного гемоглобина в основной группе снизились на 0,5%, в группе контроля (инсулин в сочетании с плацебо) - всего на 0,2%. Интересно отметить, что у больных в возрасте от 65 лет и старше комбинация инсулина с вилдаглиптином способствовала уменьшению уровня гликированного гемоглобина на 0,7%, в то время как в контрольной группе статистически значимой разницы по возрасту не отмечено (рис. 7).
Также необходимо отметить, что эпизоды гипогликемии регистрировались существенно реже в основной группе, что, вероятно, обусловлено повышением чувствительности a-клеток поджелудочной железы к глюкозе (рис. 8) .
Комбинация вилдаглиптина
с метформином
Необходимо отметить, что к настоящему времени проведена целая серия работ, в которых убедительно доказана целесообразность комбинированной терапии вилдаглиптина с метформином. Вилдаглиптин в комбинации с метформином оказывает синергичное влияние на синтез и активность ГПП-1 , обеспечивает эффективный гликемический контроль без риска развития гипогликемий и повышения массы тела.
Так, уже в одном из наиболее ранних рандомизированных исследований было продемонстрировано, что подобная комбинация позволяет добиться значимого улучшения показателей углеводного обмена, причем эти результаты оставались стабильными в течение года после завершения исследования. В данной работе вилдаглиптин в дозе 50 мг добавлялся к терапии метформином, что уже через 12 недель привело к снижению уровня гликированного гемоглобина на 0,6% по сравнению с исходным значением (7,7%). В группе контроля (монотерапия метформином) существенных изменений не отмечалось. Все последующие 40 недель на фоне комбинированной терапии сохранялся положительный результат лечения, в то время как в контрольной группе наблюдалось прогрессирующая отрицательная динамика (увеличение гликированного гемоглобина на 0,066% ежемесячно). За счет этого разница между группами по уровню гликированного гемоглобина изменилась с -0,7% (12-я неделя наблюдения) до -1,1% (40-я неделя исследования).
В другом исследовании сравнивалась эффективность комбинированной терапии вилдаглиптин 50 мг 2 р/сут. + метформин 1500 мг/сут. с терапией глимепирид 6 мг в сутки + метформин 1500 мг/сут. Было показано, что в течение года терапии гликемический контроль поддерживался одинаково в обеих группах терапии со средним снижением HbA1c на 0,7-0,8% (при исходном HbA1c - 7,3%) (рис. 9) . Через 1 год терапии разница в динамике массы тела составила 2,8 кг. Частота гипогликемий в группе терапии вилдаглиптин + метформин оказалась минимальной, а тяжелых эпизодов не было зарегистрировано вообще .
Важно отметить, что при комбинированном на-значении вилдаглиптина и метформина побочные эффекты со стороны желудочно-кишечного тракта наблюдались гораздо реже, чем на фоне монотерапии метформином .
В последние годы появились сведения о том, что метформин способствует увеличению уровня ГПП-1. Среди предполагаемых механизмов обсуждается роль бигуанидов в непосредственном усилении секреторной функции L-клеток кишечника, активации транскрипции/трансляции гена проглюкагона, снижении почечной экскреции ГПП-1, блокаде ДПП-4 .
Таким образом, преимущества комбинированной те-рапии вилдаглиптина и метформина (аддитивное влияние на углеводный обмен и комлементарный механизм действия) предопределили необходимость создания фиксированной комбинации этих препаратов. Возможность одномоментного воздействия на ключевые звенья патогенеза сахарного диабета 2 типа - инсулинорезистентность и нарушение функции островковых клеток поджелудочной железы - обеспечивает высокий потенциал данного вида терапии. В странах Евросоюза вилдаглиптин/метформин (Eucreas) используется с 2007 г., в Российской Федерации препарат ГалвусМет зарегистрирован в марте 2009 г. Важно отметить, что препараты Галвус и ГалвусМет уже широко используются более чем в 50 странах мира.
В настоящее время на кафедре эндокринологии и диабетологии с курсом эндокринной хирургии ГОУ ДПО РМАПО изучается эффективность и безопасность комбинированной терапии ингибитора ДПП-4 - вилдаглиптина (Галвус) с различными сахароснижающими препаратами у пациентов с неудовлетворительным контролем сахарного диабета 2 типа. Первые результаты исследования свидетельствуют, что вилдаглиптин эффективно снижает уровень глюкозы крови как натощак, так и через 2 часа после еды, не вызывает повышения массы тела и развития гипогликемий. Кроме того, наши данные убедительно доказывают, что терапия вилдаглиптином обеспечивает достоверное и клинически значимое снижение вариабельности гликемии в течение суток. Этот аспект является особенно важным в плане предо-твращения развития наиболее тяжелых макрососудистых осложнений диабета. В группу изучения эффективности комбинации вилдаглиптина с метформином было включено 20 пациентов (5 мужчин и 15 женщин) с сахарным диабетом 2 типа, средний возраст 43,5±8,4 (от 28 до 63) лет, ИМТ - 34,00±6,80 кг/м2, окружность талии (ОТ) 114,79±13,47 см., получающие метформин в суточной дозе 1500-3000 мг. К терапии добавляли вилдаглиптин (Галвус) 50-100 мг/сут. в комплексе с индивидуально подобранным планом питания и режимом физической активности. Состояние углеводного обмена оценивалось по уровню гликемии перед и через 2 часа после еды, HbA1c, инсулину, С-пептиду, среднему значению гликемии в течение 3 суток, продолжительности периода нормогликемии, гипергликемии, гипогликемии в течение 3 суток, колебанию гликемии - ее вариабельности (количество гипо- и гипергликемических экскурсий, продолжительность экскурсий) по данным результата суточного мониторирования гликемии. Через 12 недель терапии вилдаглиптином 50-100 мг/сут. и метформином 1500-3000 мг/сут. была достигнута достоверная динамика всех показателей углеводного обмена: гликемия перед едой снизилась с 10,8±0,81 до 6,2±0,95 ммоль/л (p<0,001), постпрандиальная гликемия с 14,6±1,2 ммоль/л до 8,5±0,98 ммоль/л (p<0,001), HbA1c с 8,23±0,81 до 6,64±0,64% (p<0,001), среднее значение гликемии в течение 3 суток снизилось с 9,24±1,94 до 7,64±2,26 ммоль/л (p<0,001), продолжительность пе-риода нормогликемии увеличилась с 26,33±10,8 до 57,71±14,64% (p<0,001), гипергликемии с 73,67±10,8 до 41,86±14,64% (p<0,001), по данным результата суточного мониторирования гликемии достоверной динамики вариабельности гликемии и развития эпизодов гипогликемии не зафиксировано. Отмечалась положительная динамика массы тела и ОТ. Через 12 недель на фоне коррекции образа жизни и применения комбинированной терапии масса тела снизилась с 96,84±16,14 до 87,63±14,3 кг (p<0,001), ОТ уменьшилась с 114,79±13,47 до 105,6±13,0 см (p<0,001). Побочных эффектов не наблюдалось, биохимические параметры оставались в норме. Отмечалась хорошая переносимость, а также, что немаловажно - улучшение качества жизни пациентов. Таким образом, в нашем исследовании вилдаглиптин в комбинированной терапии с метформином на фоне соблюдения плана питания и режима физической активности показал высокую эффективность в компенсации углеводного обмена, при этом вариабельность гликемии оставалась без динамики.







Литература
1. Fonseca V, at al. Addition of vildagliptin to insulin improves glycaemic control in type 2 diabetes. Diabetologia. 2007; 50:1148-1155.
2. King Н, Aubert RE &Herman WH. Global burden of diabetes, 1995-2025: prevalence, numerical estimates, and projections. Diabetes Care 1998; 1414-1431.
3. Niskanen L, Turpeinen A, Penttila I, Uusitupa MI. Hyperglycemia and compositional lipoprotein abnormalities as predictors of cardiovascular mortality in type 2 diabetes: a 15-year follow-up from the time of diagnosis. Diabetes Care 1998; 21 (11):1861-1869.
4. Manson JE, Colditz GA, Stampfer MJ, et al. A prospective study of maturity-onset diabetes mellitus and risk of coronary heart disease and stroke in women. Arch Intern Med. 1991; 151: 1141-1147.
5. Garber A.G., et al. Efficacy and Tolerability of Vildagliptin Added to a Sulfonylurea in Patients with Type 2 Diabetes. Presented at ADA, 22-26 June 2007 (Abstract 501-P).
6. Fonseca V., Dejager S., Albrecht S. et al. Vildagliptin as add-on to insulin in patients with type 2 diabetes (T2DM). Diabetes 2006; 55(suppl 1):A111.
7. Neaton JD, Wentworth DN, Cutler J, Stamler J,Kuller L Risk factors for death from different types of stroke. Multiple Risk Factor Intervention trial Reasearch Group. Ann Epidemiol. 1993; 3:493-499.
8. Stratton JM, Adler AI, Neil AW, et al. Association of glycaemia with macrovascular and microvascular complications of type 2 diabetes (UKPDS 35): prospective, observational study. BMJ.2000; 321:405-412.
9. Croxtall J.D., Keam S.J. Vildagliptin: a review of use in the management of type 2 diabetes mellitus. Drugs 2008; 68(16): 2387-2409.
10. Halimi S., Schweizer A., Minic B. et al. Combination treatment in the management of type 2 diabetes: focus on vildagliptin and metformin as a single tablet. Vascular Health and Risk Management 2008; 4(3): 481-492.
У многих больных сахарным диабетом 2-го типа (СД 2-го типа) применение пероральных сахароснижающих препаратов (ПССП) не позволяет добиться необходимого контроля гликемии. По данным исследования UKPDS компенсация заболевания через 3 года после постановки диагноза при монотерапии ПССП достигалась только у 45% больных, а через 6 лет — лишь у 30%. Это обстоятельство диктует необходимость разработки и внедрения новых препаратов, позволяющих не только устранять метаболические нарушения, но и сохранять функциональную активность клеток поджелудочной железы, стимулируя и активируя физиологические механизмы секреции инсулина и контроля уровня глюкозы крови.
Регуляция гомеостаза глюкозы в организме осуществляется сложной полигормональной системой, включающей гормоны поджелудочной железы и гормоны инкретины, вырабатываемые в кишечнике в ответ на прием пищи. До 70% постпрандиальной секреции инсулина у здоровых людей обусловлено именно эффектом инкретинов (рис. 1) . У больных СД 2-го типа этот эффект значительно снижен (рис. 2).
Инкретинами, играющими основную роль в инсулиновом ответе на прием пищи, являются глюкозозависимый инсулинотропный полипептид (ГИП) и глюкагоноподобный пептид-1 (ГПП-1).
Поступление пищи в пищеварительный тракт быстро стимулирует выброс ГИП и ГПП-1, которые за счет совместного действия:
Стимулируют высвобождение инсулина бета-клетками и угнетают продукцию глюкагона альфа-клетками поджелудочной железы в ответ на повышение глюкозы крови;
Повышают концентрацию инсулина, способствуя утилизации глюкозы периферическими тканями;
Уменьшают высвобождение глюкозы печенью.
Инкретины могут снижать уровень гликемии также за счет «неинсулиновых» механизмов путем замедления опорожнения желудка и снижения потребления пищи.
При СД 2-го типа содержание инкретинов и их эффект снижен. Тем не менее, действие инкретинов у таких пациентов можно восстановить путем введения экзогенных препаратов . Поэтому результатом выяснения роли желудочно-кишечных гормонов (инкретинов) в регуляции углеводного обмена явилось создание принципиально нового класса сахароснижающих препаратов — инкретиномиметиков (рис. 3).
В новых рекомендациях по выбору режимов терапии и алгоритмах по поддержанию гликемического контроля, представленных на конгрессе Международной федерации диабета (Монреаль, 18-23 октября 2009), была акцентирована значимость ингибиторов дипептидилпептидазы-4 (ДПП-4) и агонистов ГПП-1. Препараты этих групп рекомендуются практически на всех этапах терапии СД 2-го типа.
Одним из представителей класса ингибиторов ДПП-4 является препарат вилдаглиптин (Галвус®), зарегистрированный в России в ноябре 2008 г. Вилдаглиптин применяется у больных СД 2-го типа в виде монотерапии в дозе 50 мг или 100 мг в сутки либо в комбинации с метформином, препаратами сульфонилмочевины (ПСМ) или инсулином.
Селективное и обратимое ингибирование фермента ДПП-4 повышает концентрацию эндогенных ГИП и ГПП-1, а также продлевает период их присутствия в плазме. Вилдаглиптин, таким образом, усиливает физиологические эффекты обоих инкретиновых гормонов, улучшая глюкозозависимую секрецию инсулина и снижая повышенную секрецию глюкагона. Снижение избыточного уровня глюкагона во время еды, в свою очередь, вызывает уменьшение инсулинорезистентности.
Ингибирование ДПП-4 было показано после однократного приема вилдаглиптина у здоровых добровольцев и многократного приема у больных СД 2-го типа. При этом длительность ингибирования была дозозависимой. Дозы в 50 мг и 100 мг 1 раз в сутки были в равной степени эффективны в ингибировании ДПП-4 во время дневного приема пищи, однако доза в 100 мг была более эффективна в ночной период.
Повышение уровней ГПП-1 и ГИП было продемонстрировано у больных СД 2-го типа, получавших вилдаглиптин в течение 4 недель; отмечалось повышение уровней инкретинов после приема пищи и натощак. Повышенные уровни наблюдались как в течение дня, так и в ночные часы.
Основным клиническим эффектом препарата является улучшение контроля гликемии, снижение уровня гликированного гемоглобина HbA1c (интегрального показателя контроля углеводного обмена за 2-3 мес). Это позволяет большему количеству пациентов достичь терапевтических целей лечения. Эффекты снижения уровня гликемии и HbA1с изучались различными методами (уровень глюкозы в плазме натощак и после приема пищи, суточный гликемический профиль, продукция эндогенной глюкозы). Вилдаглиптин снижал уровень глюкозы в плазме после приема пищи у больных СД 2-го типа как в монотерапии, так и в комбинации с препаратами сулфонилмочевины или метформином, наиболее часто применяемыми ПССП . Кроме того, на фоне приема вилдаглиптина (4 недели) у больных СД 2-го типа отмечалось снижение уровня триглицеридов сыворотки.
Таким образом, можно говорить о многокомпонентном действии вилдаглиптина, которое включает:
Ингибирование ДПП-4 (основное действие);
Повышение уровней ГПП-1 и ГИП (требуемый эффект);
Влияние на функции островков поджелудочной железы (усиление инсулинового ответа бета-клеток и уменьшение глюкагонового ответа альфа-клеток на глюкозу) и резистентность к инсулину;
Влияние на гликемический профиль (снижение уровня глюкозы натощак и после приема пищи) и эндогенную продукцию глюкозы;
Снижение уровня липидов после приема пищи;
Влияние на опорожнение желудка.
Более 20 тыс. пациентов принимали участие в клинических испытаниях вилдаглиптина, при этом 14 тыс. пациентов непосредственно получали препарат. Все исследования были контролируемыми, многоцентровыми, двойными слепыми в параллельных группах.
Вилдаглиптин в сравнении с росиглитазоном в качестве монотерапии
Проводилось сравнение эффективности и переносимости терапии вилдаглиптином и росиглитазоном в течение 24 недель терапии . Пациенты, включенные в исследование, ранее не получавшие медикаментозной терапии, с исходным HbA1c 7,5-11,0% были рандомизированы на терапию вилдаглиптином (50 мг ´ 2 раза/сутки) или росиглитазоном (8 мг ´ 1 раз в сутки). В исследование включено 697 пациентов с СД 2-го типа (вилдаглиптин n = 459; росиглитазон n = 238). Основным параметром исследования была динамика HbA1c: исходно и через 24 недели. Вторичные параметры исследования: динамика глюкозы плазмы натощак, уровень липидов в плазме натощак, динамика массы тела, частота возникновения отеков на фоне проводимой терапии.
Результаты исследования показали достоверное снижение уровня HbA1c по сравнению с исходными значениями на -1,1% и -1,3% для вилдаглиптина и росиглитазона соответственно (р < 0,001 для обоих препаратов) (рис. 4).
У пациентов с исходно высоким HbA1c (> 9%) была показана достоверно большая динамика снижения в обеих группах терапии: -1,8% в группе терапии вилдаглиптином (исходно 10,0%) и -1,9% в группе терапии росиглитазоном (исходно 9,9%). При этом отмечались статистически значимые (р < 0,001) различия по изменению массы тела между группами лечения: вилдаглиптин не влиял на массу тела, прием росиглитазона приводил к ее увеличению в среднем на 4,7 кг. Более высокая частота возникновения периферических отеков была выявлена в группе терапии росиглитазоном (11,1%) по сравнению с группой на терапии вилдаглиптином (4,6%). Результаты показали, что при равной сахароснижающей эффективности вилдаглиптин обеспечивает лучшую переносимость.
Добавление вилдаглиптина к терапии метформином в сравнении с терапией ПСМ или «ПСМ + метформин»
Эффективность и безопасность вилдаглиптина (50 мг ´ 2 раза/сутки) и глимепирида (препарата из группы сульфонилмочевины, использовался в дозе до 6 мг/сутки) изучалась при длительном применении (52 недели) у пациентов с недостаточно хорошим контролем гликемии (HbA1c 6,5-8,5%) при приеме метформина (постоянная доза ~1,9 г/сутки). Через год отмечалось снижение HbA1c в обеих группах (вилдаглиптин -0,4%; глимепирид -0,5%) (рис. 5) . Таким образом, при добавлении к метформину вилдаглиптин показал эффективность, сходную с глимепиридом.
Кроме того, в течение исследования масса тела пациентов, принимавших вилдаглиптин, оставалась стабильной, тогда как у больных, принимавших глимепирид, отмечалась прибавка веса. Различия между группами через 52 недели составили 1,8 кг. Через 52 недели терапии у пациентов, получавших вилдаглиптин + метформин, прибавки веса отмечено не было.
Особое внимание уделялось сравнению числа гипогликемий в обеих группах: 1,7% пациентов из группы вилдаглиптина (n = 1389) и 16,2% пациентов из группы глимепирида (n = 1383) перенесли ≥ 1 гипогликемического эпизода (рис. 6).
Было зарегистрировано 39 гипогликемических эпизодов в группе вилдаглиптина и 554 — в группе глимепирида. В группе вилдаглиптина не было отмечено тяжелых (2-й или близких ко 2-й степени) гипогликемических эпизодов, тогда как в группе глимепирида зарегистрировано 10 тяжелых гипогликемических эпизодов. К концу 52 недели в группе вилдаглиптина было отмечено меньше гипогликемических эпизодов .
Вилдаглиптин + инсулин НПХ
В исследовании длительностью 24 недели сравнивались эффекты терапии вилдаглиптином (50 мг ´ 2 раза/сутки, n = 144) или плацебо (n = 152) у пациентов с СД 2-го типа, получавших инсулинотерапию (как минимум в течение 3 мес в дозе > 30 Ед/сутки) и не достигших адекватного контроля гликемии (исходный HbA1c 7,5-11%). Основным параметром данного исследования являлась оценка эффективности добавления вилдаглиптина к инсулину в плане влияния на снижение HbA1c в сравнении с монотерапией инсулином (рис. 7).
В целом, добавление вилдаглиптина к инсулину достоверно снизило уровень HbA1c в сравнении с исходными значениями и с группой монотерапии. Межгрупповая разница составила -0,3% (P = 0,01). У пациентов в подгруппе старше ≥ 65 лет также было отмечено достоверное и более выраженное снижение гликемии, чем в группе «вилдаглиптин + инсулин»: -0,7% HbA1c в сравнении с исходными значениями (р < 0,001).
Кроме того, было доказано, что достоверно меньшее число пациентов в группе терапии «вилдаглиптин + инсулин» имело эпизоды гипогликемии (23% пациентов сообщили о 113 эпизодах; P < 0,01) в сравнении с терапией «плацебо + инсулин» (30% пациентов сообщили о 185 эпизодах). В группе терапии «вилдаглиптин + инсулин» не было ни одного эпизода тяжелой гипогликемии в сравнении с терапией «инсулин + плацебо», где было отмечено 6 эпизодов (рис. 8). Таким образом, несмотря на выраженный сахароснижающий эффект, вилдаглиптин обеспечивает снижение частоты гипогликемических реакций, особенно тяжелых.
Вилдаглиптин + метформин
Комбинация «вилдаглиптин + метформин» позволила достичь снижения уровня HbA1c на 1,1% по сравнению с группой, принимавшей метформин + плацебо . Пациенты, недостаточно контролирующие уровень гликемии на монотерапии метформином, при комбинированном применении метформина и вилдаглиптина в 4 раза чаще достигают компенсации заболевания по сравнению с комбинацией «метформин + плацебо» . Помимо этого, добавление вилдаглиптина к терапии метформином продемонстрировало такую же эффективность, как и применение метформина с тиазолидиндионами (ТЗД). При этом не наблюдалось набора веса (рис. 9).
Эффективность длительного применения вилдаглиптина подтверждена исследованием моно- и комбинированной терапии, продолжительностью 52 недели (рис. 10).
Результаты, полученные при совместном использовании вилдаглиптина и метформина, обосновали идею создания комбинированного препарата ГалвусМет® (вилдаглиптин + метформин), который зарегистрирован в России в марте 2009 года. ГалвусМет® назначается в тех случаях, когда монотерапия метформином не дает существенного результата. Вилдаглиптин в комбинации с метформином обеспечивает надежный контроль уровня глюкозы в крови. ГалвусМет® выпускается в трех дозировках: 50 мг вилдаглиптина + метформин в дозе 500 мг, 850 мг или 1000 мг. Принимается 2 раза в день.
Частота развития нежелательных побочных эффектов на фоне терапии вилдаглиптином
Общая частота нежелательных явлений была сравнимой в группах «вилдаглиптин + метформин» и «плацебо + метформин». Снижение частоты нарушений со стороны желудочно-кишечного тракта (ЖКТ) отмечалось при комбинации «вилдаглиптин + метформин» в 15% случаев по сравнению с комбинацией «плацебо + метформин» — 18%. Частота нежелательных явлений не увеличивалась с продолжительностью терапии. Частота серьезных нежелательных явлений была низкой и сравнимой для обеих групп. Из клинически значимых нежелательных явлений головная боль встречалась более часто при приеме вилдаглиптина, чем при приеме «плацебо + метформин». Не отмечено ухудшения побочных эффектов метформина при добавлении к терапии вилдаглиптина.
В исследованиях комбинированной терапии применение вилдаглиптина не было связано с повышением частоты гипогликемий при комбинации с метформином. Процент пациентов с гипогликемическими явлениями в группе «вилдаглиптин + глимепирид» был слегка выше, чем в соответствующей группе плацебо (2,4% по сравнению с 0,6%). Отмечавшиеся явления гипогликемии были легкой степени тяжести и не приводили к прекращению приема препарата. Как и ожидалось, значительно большая частота гипогликемии наблюдалась в исследовании с инсулином, но ее частота была ниже в группе «вилдаглиптин + инсулин» (23%), чем в группе «плацебо + инсулин» (30%). В группе «плацебо + инсулин» большее количество гипогликемических реакций имело среднюю степень тяжести. В этой же группе было отмечено несколько тяжелых эпизодов.
По сравнению с метформином, пациенты с уже существующими факторами сердечно-сосудистого риска (сердечно-сосудистые заболевания, гипертензия и/или дислипидемия) не показали более высокой частоты смертей, инфаркта миокарда (ИМ) или инсульта при приеме вилдаглиптина. Отдельные сердечно-сосудистые нарушения (гипертензия, значимые отклонения ЭКГ) не увеличивались при моно- или комбинированной терапии.
Таким образом, основными свойствами вилдаглиптина в отношении нежелательных побочных эффектов являются:
Переносимость и безопасность, схожие с плацебо, без увеличения общей частоты нежелательных явлений в отношении основных систем и органов как при моно-, так и комбинированной терапии;
Лучшая переносимость со стороны ЖКТ по сравнению с метформином;
Отсутствие увеличения риска гипогликемий: препарат не повышал частоту гипогликемии при монотерапии и в комбинации с инсулином, демонстрировал меньшее количество и более легкую степень тяжести эпизодов гипогликемии, чем инсулин + плацебо, не показал увеличения частоты эпизодов гипогликемии в комбинации с метформином.
Кроме того, вилдаглиптин не повышает сердечно-сосудистый риск, не вызывает увеличения массы тела, повышения частоты возникновения отеков или сердечной недостаточности, обладает нейтральным эффектом в отношении уровня липидов натощак и оказывает положительное влияние на липидный профиль после приема пиши.
Заключение
Современная эпидемиологическая ситуация характеризуется, с одной стороны, значительным ростом заболеваемости СД 2-го типа, а с другой стороны, недостаточной эффективностью существующих методов терапии. В этой ситуации все актуальнее становятся разработка и внедрение новых препаратов для лечения СД 2-го типа. Роль инновационных препаратов с оригинальными механизмами действия будет все более значимой, так как они открывают новые возможности коррекции дисфункции островков поджелудочной железы при СД 2-го типа и влияния на прогрессирование заболевания. Вилдаглиптин, являясь представителем нового класса препаратов для лечения СД 2-го типа, обладает рядом достоинств по сравнению с традиционной терапией. За счет подавления активности ДПП-4 препарат повышает уровень инкретиновых гормонов (ГПП-1 и ГИП). В свою очередь, их повышенные уровни, увеличивая уровень инсулина и снижая уровень глюкагона, позволяют добиться более эффективного контроля глюкозы крови и снижения продукции глюкозы печенью. Это приводит к наиболее важному клиническому эффекту — достижению компенсации заболевания (снижение HbA1с).
Литература
Garber A. et al. Effects of Vildagliptin on Glucose Control in Patients with Type 2 Diabetes Inadequately Controlled with a Sulphonylurea // Diabetes, Obesity and Metabolism. 2008; 10: 1326-1463.
Bosi E. et al. Effects of Vildagliptin on Glucose Control Over 24 Weeks in Patients with Type 2 Diabetes Inadequately Controlled with Metformin // Diabetes Care. 2007; 30: 890-895.
Stratton I. et al. Association of Glycaemia with Macrovascular and Microvascular Complications of Type 2 Diabetes (UKPDS 35): Prospective Observational Study // BMJ. 2000; 321: 405-412.
Dejager S. et al. Achievement of Glycemic Targets with Vildagliptin // Presented at EASD, 17-21 September 2007 (Abstract A-07-899).
Bolli G. et al. Efficacy and Tolerability of Vildagliptin vs. Pioglitazone when Added to Metformin: A 24-Week, Randomized, Double-Blind Study // Diabetes, Obesity and Metabolism. 2008; 10: 82-90.
Garber A. et al. Efficacy and Tolerability of Vildagliptin Added to a Sulfonylurea (SU) in Patients with Type 2 Diabetes (T2 DM) // Presented at ADA, 22-26 June 2007 (Abstract 501-P).
Rosenstock J. et al. Efficacy and Tolerability of Initial Combination Therapy with Vildagliptin and Pioglitazone Compared with Component Monotherapy in Patients with Type 2 Diabetes // Diabetes, Obesity and Metabolism. 2007; 9 (2): 175-185.
Rosenstock J., Baron M. A., Dejager S. et al. Comparison of vildagliptin and rosiglitazone Monotherapy in patients with Type 2 Diabetes: a 24-week, double-blinde, randomized trial // Diabetes Care. 2007, 30: 217-223.
Ferrannini E. et al. 52-week efficacy and safety of vildagliptin versus glimepiride in patients with type 2 diabetes mellitus inadequately controlled on metformin monotherapy. Diabetes Obes Metab. 2009 (in press).
Fonseca V. et al. Addition of vildagliptin to insulin improves glycaemic control in type 2 diabetes // Diabetologia. 2007; 50: 1148-1155.
М. Б. Анциферов
, доктор медицинских наук, профессор
Л. Г. Дорофеева
, доктор медицинских наук
Эндокринологический диспансер Департамента здравоохранения, Москва
Механизм действия. Ингибиторы ДПП-4 были разработаны для усиления действия инкретинов при СД2, так как они замедляют деградацию инкретинов в организме и, соответственно продлевают действие эндогенных инкретинов. В результате этого действия ингибиторов ДПП-4:
Стимулируется секреция инсулина, причем только если уровень гликемии превышает гликемию натощак (так называемая глюкозо-зависимая стимуляция секреции инсулина);
Подавляется секреция глюкагона;
Стимулируется пролиферация бета-клеток и благодаря этому восстанавливается, до определенной степени, истощающийся при СД2 пул бета-клеток островков Лангерганса поджелудочной железы.
В отличие от агонистов ГПП-1 рецепторов, ингибиторы ДПП-4 не влияют ни на скорость опорожнения желудка, ни на снижение веса у тучных больных СД2.
Ситаглиптин
Фармакокинетика. После перорального приема Ситаглиптин быстро всасывается и при этом биодоступность достигает 87%, пик концентрации в сыворотке наблюдается через 1-4 часа, а период полувыведения составляет 12,4 часа. На показатели фармакокинетики Ситаглиптина не влияют возраст, раса и масса тела. До 79% Ситаглиптина в неизменном виде выделяется с мочой через механизм активной канальцевой экскреции. Ситаглипитин очень умеренно метаболизируется ферментом CYP 3A 4 и незначительно изоферментом 2С8. Так как Ситаглиптин выводится главным образом почками, то его доза должна подбираться у больных со средней или тяжелой степенью почечной недостаточности.
Взаимодействие с другими препаратами. Весьма ограниченным метаболизмом Ситаглиптина CYP 450 ферментами 3А4 и 2С8 можно объяснить отсутствие е го взаимодействия с препаратами, которые утилизируются системой CYP 450. Несмотря на то, что Ситаглиптин является р-гликопротеиновым субстратом, Ситаглиптин не блокирует p -гликопротеиновый транспорт других препаратов, которые метаболизируются по этому пути. Ситаглиптин не влияет на фармакокинетические профили метформина, глибенкламида, симвастатина, варфарина или оральных контрацептивов. Когда Ситаглиптин назначается вместе с 600 мг циклоспорина, сильного ингибитора p -гликопротеиновой активности, пик концентрации Ситаглиптина повышается на 68%, но клинического значения это явление не имеет. Ситаглиптин повышает на 18% пик концентрации дигоксина и биологическую его доступность на 11%. Хотя у больных, получающих дигоксин, не рекомендуется специальным образом корректировать лечение Ситаглиптином, вместе с тем, следует проявлять особую настороженность относительно симптомов дигоксиновой интоксикации.
Препараты, дозы и схемы лечения
ЯНУВИЯ (JANUVIA )
(фирма MSD Pharmaceutical , США) - Ситаглиптин 100 мг/табл.
При применении в качестве монотерапии или в комбинации с метформином или глитазоном рекомендуемая доза препарата составляет 100 мг 1 раз/сут. Янувия может назначаться независимо от приема пищи. В случае если больной пропустил прием Янувии, то возобновить лечение следует как можно быстрее, но при этом недопустим прием двойной дозы препарата. При почечной недостаточности легкой степени тяжести (КК ≥50 мл/мин, креатинин сыворотки ≤1,7 мг% у мужчин и ≤1,5 мг% у женщин) коррекции дозы препарата не требуется. При почечной недостаточности средней степени тяжести (КК 30-50 мл/мин, креатинин сыворотки 1,7-3,0 мг% у мужчин и 1,5-2.5 мг% у женщин) доза Янувии составляет 50 мг 1 раз/сут.
При почечной недостаточности тяжелой степени (КК <30 мл/мин, креатинин сыворотки >3 мг/дл у мужчин, и >2.5 мг/дл у женщин), для больных с терминальной стадией почечной недостаточности и необходимости проведения гемодиализа доза препарата Янувия составляет 25 мг 1 раз/сут. Янувию можно применять вне зависимости от расписания процедуры гемодиализа.
Показания. Снижение уровня HbA 1c на фоне лечения Ситаглиптином весьма умеренное – 0,5-0,8%. В связи с этим его целесообразно назначать в качестве стартовой терапии СД2 в дополнение к диетотерапии и расширению объема физической активности. Кроме того он может использоваться как в виде дополнения к ранее назначенной монотерапии метформином, сульфаниламидом или глитазоном, так и дополнения недостаточно эффективного лечение двумя сахароснижающими препаратами (метформин+сульфаниламид и т.п.). Зарегистрировано комбинированное лечение ситаглиптина с инсулином.
Комбинированное лечение Ситаглиптином и Метформином (в виде единой таблетки) позиционируется производителями Ситаглиптина в качестве первой линии лечения СД2. Ситаглиптин также снижает тощаковую и постпрандиальную гликемию и не вызывает прибавку веса.
Противопоказания, побочные эффекты и ограничения. В качестве монотерапии, а также в комбинации с метформином и пиоглитазоном Ситаглиптин не повышает риск развития гипогликемии, в то время как, в сочетании глимепиридом (сульфаниламидом) наблюдалось повышение риска развития гипогликемии на 10%. В некоторых исследованиях лечение Ситаглиптином вызывало повышения числа нейтрофилов, но клиническое значение этого наблюдение пока неясно.
Ситаглиптин элиминируется преимущественно почками и потому у больных СД2 с нарушением функции почек доза препарата должна тщательно титроваться и перед первым назначением препарата обязательно должна быть исследована функция почек. В дальнейшем необходимо регулярно контролировать состояние почек. На фоне лечения Ситаглиптином 50 мг/сут у больных СД2 с умеренной почечной недостаточностью наблюдался рост сывороточного креатинина на 70% больше, чем в контроле (0,07 мг% vs 0,12 мг%).
У больных, получавших Ситаглиптин, редко наблюдались выраженные аллергические реакции и реакции гиперчувствительности, которые включали: анафилаксию, ангионевротический отек, повышенное шелушение кожи, синдром Стивен-Джонсона (острые высыпания на коже и слизистых). У больных с болезнями печени не ограничивают лечение Ситаглиптином, хотя специальных исследований у этой категории больных не проводилось.
За период с октября 2006 по февраль 2009 FDA (Federal Drug Administration, США) получило сообщения о 86 пост-маркетинговых случаях развития острого панкреатита (включая 2 случая геморрагического или некротического) панкреатита у больных, получавших Ситаглиптин. Врачам рекомендовано внимательно наблюдать за состоянием больных, чтобы не пропустить признаки развития панкреатита, особенно в начале терапии или при повышении дозы Ситаглиптина или Ситаглиптин+Метформина. Безопасность применения Ситаглиптина у больных с панкреатитом в анамнезе не изучалась. Следовательно, неизвестно, является ли эта категория больных группой повышенного риска по развитию острого панкреатита. Тем не менее FDA считает, что следует с осторожностью назначать Ситаглиптин при панкреатите в анамнезе и контролировать состояние больного.
Противопоказан Ситаглиптин при СД1 и диабетическом кетоацидозе. У беременных Ситаглиптин можно использовать только в случае крайней необходимости и он категорические запрещен у женщин в период кормления грудью, так как экскреция его с молоком у человека пока не исследовалась. Безопасность и эффективность Ситаглиптина у лиц моложе 18 лет не исследовалась.
Саксаглиптин
Механизм действия. Саксаглиптин — мощный селективный обратимый конкурентный ингибитор дипептидил пептидазы-4 (ДПП-4). После пероральной нагрузки глюкозой это подавление ДПП-4 приводит к 3-кратному повышению уровня в крови ГПП-1 и ГИП, снижению глюкагона и повышению концентрации инсулина. В результате Онглиза улучшает контроль гликемии у больных СД2 – снижается тощаковая и постпрандиальная гликемия и HbA 1c . Терапия Саксаглиптином не влияла на динамику массы тела.
Фармакодинамика и фармакокинетика. Саксаглиптин быстро абсорбируется после перорального приема натощак с достижением максимальной концентрации Саксаглиптина и его основного метаболита в плазме крови в пределах 2 и 4 ч, соответственно. Степень его всасывания пропорционально принятой дозе. Период полувыведения для Саксаглиптина и его основного метаболита составляли соответственно 2,5 и 3,1 ч, а среднее значение T1/2 угнетения фермента в плазме ДПП-4 - 26,9 ч. Угнетение плазменной активности ДПП-4 Саксаглиптином на протяжении не менее 24 ч после перорального приема Саксаглиптина происходит благодаря высокой мощности, аффинности и широкому связыванию с активным участком. Никакой заметной кумуляции Саксаглиптина или его основного метаболита при условиях многократного приема дозы в режиме 1 раз в сутки при любом уровне дозы не наблюдалось. Не выявлено дозо- и временной зависимости клиренса Саксаглиптина и его основного метаболита при приеме Саксаглиптина 1 раз в сутки. Количество Саксаглиптина, абсорбируемого после приема пероральной дозы, составляет не менее 75% и на него клинически значимо не влияет прием пищи. Саксаглиптин не связывается с белками сыворотки. Метаболизируется Саксаглиптина в основном при участии цитохрома P450 3A4/5 (CYP 3A4/5). Основной метаболит Саксаглиптина - также селективный, обратимый, конкурентный ингибитор ДПП-4, обладает в 2 раза меньшей мощностью, чем Саксаглиптин. Саксаглиптин выделяется почками и печенью.
Взаимодействие с другими препаратами. У Саксаглиптина низкий риск клинически значимых лекарственных взаимодействий с препаратами метформин, глибенкламид, пиоглитазон, дигоксин, симвастатин, омепразол, антациды или фамотидин. Кроме того, Саксаглиптин не изменял фармакокинетики метформина, глибенкламида, пиоглитазона, дигоксина, симвастатина, дилтиазема или кетоконазола. Одновременное назначение Саксаглиптина с мощными ингибиторами CYP 3A4/5 (кетоконазол, атазанавир, кларитромицин, индинавир, итраконазол, нефазодон, нелфинавир, ритонавир, саквинавир и телитромицин) повышало эффективность действия Саксаглиптина и в этом случае его доза должна быть уменьшена до 2,5 мг/сут. Умеренные ингибиторы CYP 3A4/5 (дилтиаземом ампренавир, апрепитант, эритромицин, флуконазол, фозампренавир, грейпфрутовый сок и верапамил), хотя и увеличивают эффективность Ситалглиптина, но не настолько, чтобы необходимо было корректировать его дозу. Действие индукторов ферментов CYP 3A4/5 (рифампицин, карбамазепин, дексаметазон, фенобарбитал и фенитоин), не изучалось, но теоретически может снижать эффективность Саксаглиптина.
Препарат, дозы и схемы лечения.
ОНГЛИЗА (ONGLYZA )
(BRISTOL -MYERS SQUIBB Company , ASTRAZENECA UK , Ltd ) – Саксаглиптин 2,5 и 5 мг/табл.
Рекомендованная при СД2 доза препарата как в качестве монотерапии, так и в комбинации с другими таблетированными сахароснижающими препаратами составляет 5 мг 1 раз в сутки. Саксаглиптин можно принимать независимо от приема пищи. Сочетание с инсулином не изучалось.
Ограничения, противопоказания и побочные эффекты. Нет ограничений для Саксаглиптина у больных СД2 с легкой степенью почечной недостаточности (КК >50 мл/мин, креатинин сыворотки < 1,7 мг% у мужчин и <1,5 мг% у женщин), Для больных с умеренной и тяжелой почечной недостаточностью или с терминальной стадией заболевания почек, требующей применения гемодиализа (КК ≤50 мл/мин, креатинин сыворотки 1,7 мг% у мужчин и 1,5 мг» у женщин), доза Саксаглиптина составляет 2,5 мг/сут. Препарат Саксаглиптин следует применять после гемодиализа.
У пожилых больных (старше 65 лет) с сохраненной функцией почек фармакокинетические параметры точно такие и молодых и потому в пожилых никаких ограничений в лечении Саксаглиптином нет.
Препарат противопоказан при гиперчувствительности к нему или другим ингибиторам ДПП-4.
Так как исследований Саксаглиптина у беременных и кормящих не проводилось, то в эти периоды лечение препаратом противопоказано. Исследований у детей не проводилось и потому он противопоказан в детском возрасте.
Побочные реакции - инфекции верхних дыхательных путей, мочевыводящих путей, гастроэнтерит, синусит, рвота, головная боль. Со стороны крови – незначительное снижение абсолютного числа лимфоцитов, которое клинического значения не имеет.
Риск гипогликемии при применении сульфаниламидов в комбинации с Саксаглиптином повышается, что может потребовать снижения дозы сульфаниламида.
Учитывая наличие головокружения как побочной реакции, во время лечения Саксаглиптином необходимо воздержаться от управления транспортными средствами или работы с другими механизмами.
Вилдаглиптин (Галвус)
Механизм действия. Вилдаглиптин, ингибируя быстро и полно активность ДПП-4 (> 90%), вызывает повышение как базальной, так и стимулированной приемом пищи секреции глюкагоноподобного пептида 1 типа (ГПП-1) и глюкозозависимого инсулинотропного полипептида (ГИП) из кишечника в системный кровоток в течение всего дня. Увеличивая уровни ГПП-1 и ГИП, вилдаглиптин повышает чувствительности β-клеток поджелудочной железы к стимулирующему действию глюкозы на секрецию инсулина; причем эта стимуляция проявляется только при уровне гликемии выше тощаковой (глюкозо-зависимая секреция инсулина). Повышая уровень эндогенного ГПП-1, вилдаглиптин специфически подавляет секрецию глюкагона (тоже глюкозо-зависимо). В результате, увеличение соотношения инсулин/глюкагон вызывает уменьшение продукции глюкозы печенью как в прандиальный период, так и после приема пищи, что приводит к снижению гликемии. Кроме того, на фоне применения вилдаглиптина отмечается снижение уровня липидов в плазме крови, однако этот эффект не связан с его действием на ГПП-1 или ГИП и улучшением функции β -клеток поджелудочной железы.
Фармакокинетика и фармакодинамика. Вилдаглиптин быстро абсорбируется при приеме внутрь с абсолютной биодоступностью 85%. В терапевтическом диапазоне доз увеличение максимальной концентрации вилдаглиптина в плазме (Cmax) и площади по кривой «концентрация-время» (AUC) практически прямо пропорционально повышению дозы препарата. После приема внутрь натощак время достижения максимальной концентрации вилдаглиптина (Cmax) в крови составляет 1 час 45 минут. При одновременном приеме с пищей скорость абсорбции препарата снижается незначительно: отмечается уменьшение Cmax на 19% и увеличение времени ее достижения до 2 часов 30 минут. Однако прием пищи не оказывает влияния на степень абсорбции и AUC. Связывание вилдаглиптина с белками плазмы низкое (9,3%).
Биотрансформация является основным путем выведения вилдаглиптина. В организме у человека подвергается превращению 69% дозы препарата. Основной метаболит - LAY151 (57% дозы) фармакологически неактивен.
Вилдаглиптин не метаболизируется при участии изоферментов цитохрома P450. Вилдаглиптин не является субстратом изоферментов P (CYP)450, не ингибирует и не индуцирует изоферменты цитохрома CYP450
После приема внутрь препарата около 85% дозы выводится почками и 15% - через кишечник, почечная экскреция неизмененного вилдаглиптина составляет 23%. Период полувыведения после приема внутрь составляет около 3 часов независимо от дозы. Пол, индекс массы тела и этническая принадлежность не оказывают влияния на фармакокинетику вилдаглиптина.
У больных с легкими и умеренными нарушениями функции печени (6-10 баллов по классификации Child -Pugh ) после однократного применения препарата отмечается снижение биодоступности вилдаглиптина на 20% и 8%, соответственно. У больных с тяжёлой печёночной недостаточностью (12 баллов по классификации Child -Pugh ) биодоступность вилдаглиптина повышается на 22%. Увеличение или уменьшение максимальной биодоступности вилдаглиптина, не превышающее 30%, не является клинически значимым. Корреляции между степенью тяжести нарушений функции печени и биодоступностью препарата не выявлено.
У больных с легкими, умеренными и тяжелыми нарушениями функции почек, у больных с терминальной стадией хронической почечной недостаточности (ХПН) на гемодиализе отмечается повышение Cmax на 8-66% и AUC на 32-134%, не коррелирующее с тяжестью нарушения, а также увеличение AUC неактивного метаболита LAY151 в 1,6-6,7 раза, зависящее от тяжести нарушения. Период полувыведения вилдаглиптина не изменяется.
Максимальное увеличение биодоступности препарата на 32% (увеличение Cmax на 18%) у людей старше 70 лет не является клинически значимым и не влияет на ингибирование ДПП-4.
Фармакокинетические особенности вилдаглиптина у детей и подростков младше 18 лет не установлены.
Взаимодействие с другими препаратами. Галвус обладает низким потенциалом лекарственного взаимодействия.
Поскольку Галвус не является субстратом ферментов цитохрома Р (CYP) 450, а также не ингибирует и не индуцирует эти ферменты, взаимодействие Галвус с лекарственными препаратами, которые являются субстратами, ингибиторами или индукторами P (CYP) 450, маловероятно. При одновременном применении вилдаглиптин также не влияет на скорость метаболизма препаратов, являющихся субстратами ферментов: CYP1A2, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1 и CYP3A4/5. Клинического значимого взаимодействия Галвуса с препаратами, наиболее часто используемыми при лечении сахарного диабета 2 типа (глибенкламидом, пиоглитазоном, метформином) или обладающими узким терапевтическим диапазоном (амлодипином, дигоксином, рамиприлом, симвастатином, валсартаном, варфарином) не установлено.
Препарат, дозы и схемы лечения
ГАЛВУС (GALVUS )
(фирма НОВАРТИС, Швейцария) – вилдаглпитин, таблетки 50 мг.
Галвус принимают внутрь независимо от приема пищи. Рекомендуемая доза препарата при проведении монотерапии или в составе двухкомпонентной комбинированной терапии с метформином, тиазолидиндионом или инсулином, составляет 50 мг или 100 мг в сутки. У больных с более тяжелым течением сахарного диабета 2 типа, получающих лечение инсулином, Галвус рекомендуется применять в дозе 100 мг/сут. Дозу 50 мг/сут следует назначать в один прием утром. Дозу 100 мг/сут следует назначать по 50 мг 2 раза в сутки утром и вечером. При применении в составе двухкомпонентной комбинированной терапии с производными сульфонилмочевины рекомендуемая доза Галвуса составляет 50 мг 1 раз в сутки утром. При назначении в комбинации с производными сульфонилмочевины эффективность терапии препаратом в дозе 100 мг/сут была сходной с таковой в дозе 50 мг/сут.При недостаточном клиническом эффекте на фоне применения максимальной рекомендуемой суточной дозы 100 мг для лучшего контроля гликемии возможно дополнительное назначение других гипогликемических препаратов: метформина, производных сульфонилмочевины, тиазолидиндиона или инсулина.
У больных с легкими нарушениями функции почек и печени не требуется коррекции режима дозирования препарата. У больнойов пожилого возраста не требуется коррекции режима дозирования Галвуса. Поскольку опыта применения Галвуса у детей и подростков младше 18 лет нет, не рекомендуется применять препарат у данной категории больных.
При применении вилдаглиптина у 5795 больных с сахарным диабетом 2 типа в течение от 12 до 52 недель в качестве монотерапии или в комбинации с метформином, производными сульфонилмочевины, тиазолидиндионом, или инсулином отмечалось достоверное длительное снижение концентрации гликированного гемоглобина (HbA 1c ) и глюкозы крови натощак.
Ограничения, противопоказания и побочные эффекты. При применении Галвуса в качестве монотерапии или в комбинации с другими препаратами большинство нежелательных реакций были слабо выражены, имели временный характер и не требовали отмены терапии. Корреляции между частотой нежелательных явлений и возрастом, полом, этнической принадлежностью, продолжительностью применения или режимом дозирования не выявлено.
Поскольку в редких случаях при применении вилдаглиптина отмечалось повышение активности аминотрансфераз (как правило, без клинических проявлений), рекомендуется определять печеночные тесты перед назначением Галвуса и в течение первого года лечения (1 раз в 3 месяца). Если у больного выявлена повышенная активность аминотрансфераз, этот результат следует подтвердить повторным исследованием, а затем регулярно проводить определение биохимических показателей функции печени до тех пор, пока они не нормализуются. Если превышение активности АсАт или АлАт оказалось в 3 раза выше нормы при повторном исследовании, то препарат следует отменить. При развитии желтухи или других признаков нарушения функции печени на фоне лечения Галвусом, препарат немедленно отменяется. После нормализации показателей функции печени лечение Галвусом возобновлять нельзя.
Препарат противопоказан больным СД1 и при диабетическом кетоацидозе.
При развитии головокружения на фоне лечения препаратом больнойам не следует управлять автотранспортом или работать с механизмами.
Доброго времени суток, постоянные читатели и гости блога! Сегодня будет непростая статья о современных лекарствах, которые уже используют врачи всего мира.
Что такое инкретины и инкретиномиметики, какие препараты из группы ингибиторов дипептидилпептидазы 4 и агонистов глюкагоноподобного пептида 1 используют в лечении диабета? Сегодня вы узнаете, что означают эти длинные и сложные слова, а самое главное как применить полученные знания.
В данной статье речь пойдет о совершенно новых препаратах - аналогах глюкагоноподобного пептида 1 (ГПП1) и блокаторах дипептидилпептидазы 4 (ДПП4). Эти препараты были изобретены при исследованиях инкретиновых гормонов – тех, которые принимают непосредственное участие в синтезе инсулина и утилизации глюкозы в крови.
Инкретины и лечение сахарного диабета 2 типа
Для начала я расскажу вам, что представляют собой сами инкретины, как их еще называют кратко. Инкретины – это гормоны, которые вырабатываются в желудочно-кишечном тракте в ответ на прием пищи, повышающие уровень инсулина в крови. К инкретинам относят два гормона – глюкогоноподобный пептид-1 (ГПП-1) и глюказозависимый инсулинотропный полипептид (ГИП). Рецепторы к ГИП находятся на бета-клетках поджелудочной железы, а рецепторы к ГПП-1 находятся в различных органах, поэтому кроме стимулирования выработки инсулина, активация рецепторов к ГПП-1 ведет к появлению других эффектов этого гормона.
Вот те эффекты, которые появляются в результате работы ГПП-1:
- Стимуляция выработки инсулина бета-клетками поджелудочной железы.
- Подавление выработки глюкагона альфа-клетками поджелудочной железы.
- Замедление опорожнения желудка.
- Снижение аппетита и повышение чувства сытости.
- Положительное влияние на сердечно-сосудистую и центральную нервную системы.
Повышение синтеза и выработки инсулина ГПП-1 – процесс глюкозозависимый. Это означает, что гормон активируется и оказывает свое действие только при высокои уровне глюкозы в крови, а как только глюкоза снижается до нормальных цифр (около 4,5 ммоль/л), стимуляция секреции инсулина прекращается. Это очень важно, поскольку именно этот механизм защищает организм от гипогликемических реакций.
Если с первым и ведущим эффектом все ясно: инсулина больше – глюкозы меньше, то со вторым вам, вероятно, будет сложнее разобраться. Глюкагон – это гормон поджелудочной железы, вырабатываемый альфа-клетками. Этот гормон является абсолютной противоположностью инсулина. Глюкагон повышает уровень глюкозы в крови путем высвобождения ее из печени. Не забывайте, что в нашем организме в печени и в мышцах имеются большие запасы глюкозы как источника энергии, которые находятся в виде гликогена. Снижая выработку глюкагона, инкретины не только уменьшают высвобождение глюкозы из печени, но и тем самым опять же увеличивают синтез инсулина.
В чем положительный эффект снижения опорожнения желудка в плане лечения сахарного диабета? Дело в том, что основная часть глюкозы пищи всасывается из тонкого кишечника. Поэтому если пища будет поступать в кишечник малыми порциями, то сахар в крови будет повышаться медленнее и без резких скачков, что тоже является большим плюсом. Тем самым решается вопрос о повышении глюкозы после еды (постпрандиальной гликемии).
Ценность снижения аппетита и повышения чувства сытости в лечении сахарного диабета 2 типа вообще трудно переоценить. ГПП-1 воздействует напрямую на центры голода и насыщения в гипоталамусе. Так что это тоже большой и жирный плюс. А положительное влияние на сердце и нервную систему только-только изучается, и имеются лишь экспериментальные модели, но я уверена, что в ближайшем будущем мы узнаем об этих эффектах больше.
Кроме этих эффектов в экспериментах было доказано, что ГПП-1 стимулирует регенерацию и рост новых клеток поджелудочной железы, а разрушение бета-клеток блокирует. Таким образом этот гормон защищает поджелудочную железу от истощения и способствует увеличению массы бета-клеток.
Касалось бы, что мешает нам использовать эти гормоны в качестве лекарства? Это были бы почти идеальные лекарства, поскольку были бы идентичными человеческим гормонам. Но сложность состоит в том, что ГПП-1 и ГИП очень быстро разрушаются (ГПП-1 за 2 минуты, а ГИП за 6 минут) ферментом дипептидилпептидазой 4 типа (ДПП-4).
Но ученые нашли выход.
На сегодня в мире имеются две группы препаратов, которые так или иначе связаны с инкретинами (поскольку у ГПП-1 больше положительных влияний, чем у ГИП, то экономически выгодно было работать именно с ГПП-1).
- Препараты, которые имитируют действие человеческого ГПП-1.
- Препараты, которые блокируют действие фермента ДПП-4, тем самым продлевая действие своего гормона.
Аналоги ГПП-1 в лечении сахарного диабета 2 типа
К минусам можно отнести:
- Только подкожное введение, т. е. нет таблетированных форм.
- Концентрация ГПП-1 может повышаться в 5 раз, что увеличивает риск гипогликемических состояний.
- Повышаются эффекты только ГПП-1, на ГИП препарат не влияет.
- В 30-40 % могут наблюдаться побочные эффекты в виде тошноты, рвоты, но они носят преходящий характер.
 Баета выпускается в одноразовых шприц-ручках (по аналогии с инсулиновыми шприц-ручками) в дозе 250 мкг в 1 мг. Ручки бывают объемом 1,2 и 2,4 мл. В одной пачке - одна ручка. Начинают лечение сахарного диабета с введения дозы в 5 мкг 2 раза в сутки на 1 месяц для улучшения переносимости, а затем, если требуется, дозу повышают до 10 мкг 2 раза в сутки. Дальнейшее повышение дозы не усиливает эффект препарата, но повышает количество побочных эффектов.
Баета выпускается в одноразовых шприц-ручках (по аналогии с инсулиновыми шприц-ручками) в дозе 250 мкг в 1 мг. Ручки бывают объемом 1,2 и 2,4 мл. В одной пачке - одна ручка. Начинают лечение сахарного диабета с введения дозы в 5 мкг 2 раза в сутки на 1 месяц для улучшения переносимости, а затем, если требуется, дозу повышают до 10 мкг 2 раза в сутки. Дальнейшее повышение дозы не усиливает эффект препарата, но повышает количество побочных эффектов.
Инъекцию Баеты делают за час перед завтраком и ужином, его нельзя делать после еды. Если укол пропущен, то следующий делается в назначенное время по графику. Инъекция назначается подкожно в бедро, живот или плечо. Его нельзя вводить внутримышечно или внутривенно.
Хранить препарат нужно в темном холодном месте, т. е. на дверце холодильника, не допускайте замораживания. Шприц-ручку каждый раз после инъекции нужно хранить в холодильнике. Через 30 дней шприц-ручка с Баетой выкидывается, даже если в ней остался препарат, поскольку после этого времени препарат частично разрушается и не оказывает должного эффекта. Нельзя хранить используемый препарат с присоединенной иглой, т. е. после каждого использования иглу нужно отвинчивать и выбрасывать, а перед новой инъекцией одевать новую.
Баета может совмещаться и с другими сахароснижающими препаратами. Если препарат комбинируется с препаратами сульфонилмочевины (манинил, диабетон и пр.), то их дозу нужно снижать во избежание развития гипогликемии. , так что рекомендую переходить по ссылке и изучать, если вы еще не сделали этого. Если Баета используется совместно с метформином, то дозы метформина не изменяются, т. к. гипогликемия в этом случае маловероятна.
 Виктоза выпускается также в шприц-ручках в дозе 6 мг в 1 мл. Объем шприц-ручки составляет 3 мл. Продается по 1, 2 или 3 шприц-ручки в упаковке. Хранение и использование шприц-ручки аналогично Баете. Лечение сахарного диабета Виктозой проводится 1 раз в сутки в одно и то же время, которое может выбрать сам пациент, независимо от приема пищи. Препарат вводится подкожно в бедро, живот или плечо. Также нельзя его использовать для внутримышечного и внутривенного введения.
Виктоза выпускается также в шприц-ручках в дозе 6 мг в 1 мл. Объем шприц-ручки составляет 3 мл. Продается по 1, 2 или 3 шприц-ручки в упаковке. Хранение и использование шприц-ручки аналогично Баете. Лечение сахарного диабета Виктозой проводится 1 раз в сутки в одно и то же время, которое может выбрать сам пациент, независимо от приема пищи. Препарат вводится подкожно в бедро, живот или плечо. Также нельзя его использовать для внутримышечного и внутривенного введения.
Начальная доза Виктозы составляет 0,6 мг в сутки. Через 1 неделю уже можно постепенно увеличить дозу до 1,2 мг. Максимальная доза составляет 1,8 мг, которую можно начинать вводить через 1 неделю после повышения дозы до 1,2 мг. Выше этой дозы препарат вводить не рекомендуется. По аналогии с Баетой, Виктозу можно использовать с другими сахароснижающими препаратами.
А теперь о самом важном - о цене и доступности обоих препаратов. Эта группа препаратов не внесена ни в федеральный, ни в региональный список льготных лекарств для лечения пациентов с сахарным диабетом. Поэтому данные препараты придется покупать за собственные деньги. Скажу честно, что эти препараты не из дешевых. Цена зависит от дозы вводимого лекарства и от упаковки. Например, Баета объемом 1,2 мг содержит 60 доз препарата. Этого количества хватит на 1 мес. при условии, что назначенная суточная доза - 5 мкг. В этом случае вам препарат обойдется в среднем в 4 600 рублей в месяц. Если это Виктоза, то при минимальной суточной дозе в 6 мг препарат будет обходиться 3 400 рублей в месяц.
Ингибиторы ДПП-4 в лечении сахарного диабета 2 типа
Как я уже говорила выше, фермент дипептидилпептидаза-4 (ДПП-4) разрушает инкретиновые гормоны. Поэтому ученые решили заблокировать этот фермент, вследствие чего пролонгировать физиологическое действие собственных гормонов. Большим плюсом этой группы препаратов является увеличение обоих гормонов – ГПП-1 и ГИП, что усиливает действие препарата. Также положительным моментом является тот факт, что увеличение этих гормонов происходит в физиологичеком диапазоне не более чем в 2 раза, что полностью исключает возникновение гипогликемических реакций.
Плюсом также можно считать метод введения этих лекарств - это таблетированные препараты, не инъекции. Побочных эффектов у ингибиторов ДПП-4 практически нет, т. к. гормоны повышаются в физиологических пределах, как если бы это было у здорового человека. При использовании ингибиторов снижается уровень гликированного гемоглобина на 0,5-1,8 %. Но на массу тела эти препараты не оказывают практически никакого влияния.
На сегодня на Российском рынке имеются три препарата - Галвус (вилдаглиптин), Янувия (ситаглиптин), Онглиза (саксаглиптин).
 Янувия является самым первым препаратом из этой группы, который начали использовать сначала в США, а затем и во всем мире. Это препарат можно использовать как в монотерапии, так и в комбинации с другими сахароснижающими препаратами и даже инсулином. Янувия блокирует фермент на 24 часа, начинает действовать уже через 30 минут после приема.
Янувия является самым первым препаратом из этой группы, который начали использовать сначала в США, а затем и во всем мире. Это препарат можно использовать как в монотерапии, так и в комбинации с другими сахароснижающими препаратами и даже инсулином. Янувия блокирует фермент на 24 часа, начинает действовать уже через 30 минут после приема.
Выпускается в таблетках в дозировках по 25, 50 и 100 мг. Рекомендуемая доза – 100 мг в сутки (1 раз в сутки), можно принимать независимо от приема пищи. При почечной недостаточности доза препарата снижается до 25 или 50 мг.
Эффект от применения можно увидеть уже на первом месяце использования, снижается как тощаковый, так и постпрандиальный уровень глюкозы в крови.
Для удобства комбинированной терапии Янувию выпускают в виде комбинированного препарата с метформином - Янумет. Выпускается в двух дозах: 50 мг Янувии + 500 мг Метформина и 50 мг Янувии + 1000 мг Метформина. В такой форме таблетки принимаются 2 раза в сутки.
 Галвус также является представителем группы ингибиторов ДПП-4. Его принимают независимо от приема пищи. Начальная доза Галвуса - 50 мг 1 раз в сутки, если имеется необходимость, то дозу повышают до 100 мг, но прием распределяют по 50 мг 2 раза в сутки.
Галвус также является представителем группы ингибиторов ДПП-4. Его принимают независимо от приема пищи. Начальная доза Галвуса - 50 мг 1 раз в сутки, если имеется необходимость, то дозу повышают до 100 мг, но прием распределяют по 50 мг 2 раза в сутки.
Галвус также применяют в сочетании с другими сахароснижающими препаратами. Поэтому существует такой комбинированный препарат, как Галвусмет, который в своем составе имеет еще и метформин. Существуют таблетки с 500, 850 и 1000 мг метформина, доза Галвуса при этом остается 50 мг.
Как правило, комбинацию препаратов назначают при неэффективности монотерапии. В случае с Галвусметом препарат принимается 2 раза в сутки. В комбинации с другими препаратами Галвус принимается только 1 раз в сутки.
При легких нарушениях функции почек дозу препарата можно не изменять. При сравнении двух препаратов Янувии и Галвуса наблюдались идентичные изменения гликированного гемоглобина, постпрандиальной гликемии (сахар после еды) и гликемии натощак.
Онглиза - последний открытый препарат группы ингибиторов ДПП-4. Выпускается препарат в таблетках по 2,5 и 5 мг. Принимается независимо от приема пищи 1 раз в сутки. Также применяют как в виде монотерапии, так и в комбинации с другими сахароснижающими препаратами. Но пока не существует комбинированного препарата с метформином, как это сделано в случае с Янувией или Галвусом.
При легкой почечной недостаточности коррекции дозы не требуется, при средней и тяжелой стадии доза препарата снижается в 2 раза. При сравнении с Янувией и Галвусом также не отмечено явных и существенных отличий ни по эффективности, ни по частоте побочных эффектов. Поэтому выбор препарата зависит от цены и опыта работы врача с данным препаратом.
Эти препараты, к сожалению, не входят в федеральный список льготных лекарственных средств, но в некоторых регионах возможна выписка этих лекарств пациентам из регионального реестра за счет местного бюджета. Поэтому, опять же, эти препараты приходится покупать на собственные деньги.
По цене эти препараты также не сильно отличаются. Например, на лечение сахарного диабета Янувией в дозе 100 мг вам потребуется потратить в среднем 2 200-2 400 рублей. А Галвус в дозе 50 мг вам обойдется в 800-900 рублей в месяц. Онглиза 5 мг стоит 1 700 рублей в месяц. Цены чисто ориентировочные, брала из интернет-магазинов.
Кому же назначаются эти группы препаратов? Препараты из этих двух групп можно назначать уже во время дебюта заболевания, тем кто может себе это позволить, конечно. Особенно важно в это время сохранить, а возможно, даже и увеличить пул бета-клеток поджелудочной железы, тогда сахарный диабет будет еще долго хорошо компенсироваться и не потребует назначения инсулина.
Сколько препаратов одновременно назначают при выявлении сахарного диабета зависит от уровня гликированного гемоглобина.
И помните, что не смотря на самые эффективные лекарства, играет ведущую роль совместно с регулярными физическими нагрузками.
С теплотой и заботой, эндокринолог Лебедева Диляра Ильгизовна





